
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2→ 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3 + 4 SO2
含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
12 (2分)
3.5 (3分)  (3分)
(3分)
【解析】
试题分析:(1)FeS2中S元素的含量是
所以根据S原子守恒可知,最多可以生产98%的浓硫酸等质量为

(2)设Fe1-xS中Fe2+与Fe3+的物质的量分别是a和b
则根据原子守恒和电荷守恒可知a+b=0.9、2a+3b=2
解得a=0.7mol,b=0.2mol
所以Fe1-xS中Fe2+与Fe3+的物质的量之比为3.5︰1。
(3)设生成4mol SO2,则需要1.2 (7-3x)mol的O2,所需空气中的N2为4.8 (7-3x)mol;
反应后得到的混合气体组成为:SO2 4mol、O2 0.2 (7-3x)mol、N2 4.8 (7-3x)mol;
所以 SO2的体积分数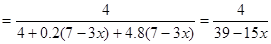
考点:考查工业生产浓硫酸以及物质含量的有关计算
点评:该题以黄铁矿和磁黄铁矿生产浓硫酸为载体,重点考查学生对化学计算的熟悉掌握情况,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范的答题能力。该题的关键是在掌握反应原理的基础上利用好守恒法。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+O2(g)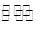 2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图不正确的是 (填序号)。
(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是 。
②在(NH4)2 SO4溶液中存在:NH+4+H2O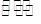 NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-5)
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp(BaCO3)=1×10-9).
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三下学期二模化学试卷(解析版) 题型:计算题
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2 → 2 (1-x) Fe2O3 + 4 SO2
(1)含FeS2 72%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl2 0.425mol,且溶液中无Fe3+,计算Fe1-xS中的x值(矿石中其他成分不与盐酸反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com