
| A、FeO |
| B、Fe3O4 |
| C、Fe2O3 |
| D、FeO2 |
| 3.36L |
| 22.4L/mol |
| 2 |
| 3 |
| 1 |
| 2 |
| 10.2g |
| 102g/mol |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| 电解质 | 电离常数(mol?L-1) |
| H3PO4 | Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13 |
| HF | Ka=6.4×10-4 |
| CH3COOH | Ka=1.7×10-5 |
| NH3?H2O | Kb=1.7×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| D、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中的氧化剂只有CuSO4 |
| B、7 mol CuSO4能氧化5mol-1价的硫 |
| C、被氧化的硫和被还原的硫个数之比是3:7 |
| D、FeS2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
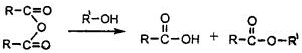

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4和C2H2 |
| B、C2H4和C3H4 |
| C、C3H4和C2H2 |
| D、C3H6和C3H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com