
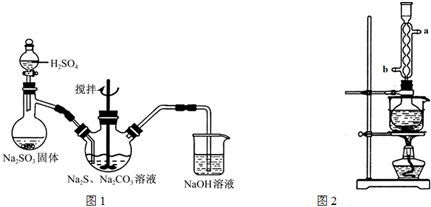
分析 (1)烧瓶中产生了二氧化硫气体,通入三颈瓶中后与Na2S发生了归中反应;若换成盐酸除了反应生成硫代硫酸钠外还有氯化钠;
(2)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管;
③局部变色就停止滴定,消耗标准溶液少,测定结果偏低;
(3)②冷凝管中水流的方向要与蒸汽的方向相反;
③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法分析判断的;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液;
⑤热的滤液冷却结晶过滤得到晶体.
解答 解:(1)烧瓶中产生了二氧化硫气体,通入三颈瓶中后与Na2S发生了价态的归中反应,Na2CO3未参与氧化还原反应,化学方程式为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;换做盐酸进行反应产物中 除了硫代硫酸盐外还有氯化钠,
故答案为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;NaCl;
(2)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准溶液体积减小,则会使样品中Na2S2O3•5H2O的质量分数的测量偏低;
故答案为:偏低;
(3)由提纯硫化钠的实验步骤和操作过程可知.
②冷凝管中水流的方向要与蒸汽的方向相反,故水流的方向由b口进,a口出,故答案为:b,a;
③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法可知,但烧瓶中固体不再减少,说明硫化钠全部溶解于酒精中,不溶的杂质沉淀过滤除去,故答案为:烧瓶中固体不再减少;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,故答案为:趁热过滤;
⑤热的滤液通过冷却、结晶、过滤得到晶体,故答案为:将所得滤液冷却结晶,过滤得到硫化钠结晶水合物.
点评 本题考查了物质制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用,掌握基础,注意积累是解题关键,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.3mol O2和0.3mol H2O | |
| B. | 6.02×1023个CO2与0.1mol KMnO4 | |
| C. | 0.1mol CuSO4•5H2O和0.1mol C6H2O6 | |
| D. | 0.1mol H2SO4和0.4NA个H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
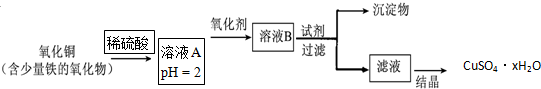

查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | X、Z可形成化学式为Z2X和Z2X2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
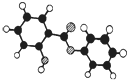 萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )| A. | 萨罗的分子式为C13H10O3 | |
| B. | 1mol萨罗与浓溴水反应,需要消耗3mol Br2 | |
| C. | 1mol萨罗发生水解,需要消耗3mol NaOH | |
| D. | 萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
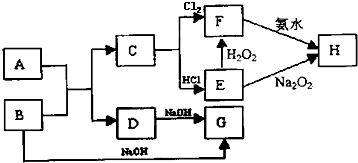
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com