
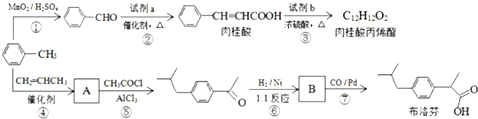
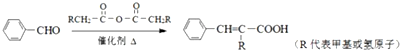
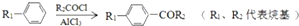
 ;
;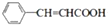 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$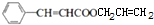 +H2O;
+H2O; ;
;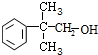 .
. 分析 甲苯发生氧化反应生成苯甲醛,由信息I、肉桂酸的结构简式可知试剂a为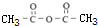 ,反应③为酯化反应,则试剂b为CH2=CHCH2OH.结合反应⑤产物结构可知该反应为取代反应,则反应④为甲苯与丙烯发生加成反应生成A为
,反应③为酯化反应,则试剂b为CH2=CHCH2OH.结合反应⑤产物结构可知该反应为取代反应,则反应④为甲苯与丙烯发生加成反应生成A为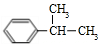 ,对比B的前后物质的结构可知,反应⑥是羰基与氢气发生加成反应生成B为
,对比B的前后物质的结构可知,反应⑥是羰基与氢气发生加成反应生成B为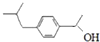 ,反应⑦为B中碳氧键断裂与CO发生加成反应生成布洛芬.
,反应⑦为B中碳氧键断裂与CO发生加成反应生成布洛芬.
解答 解:甲苯发生氧化反应生成苯甲醛,由信息I、肉桂酸的结构简式可知试剂a为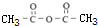 ,反应③为酯化反应,则试剂b为CH2=CHCH2OH.结合反应⑤产物结构可知该反应为取代反应,则反应④为甲苯与丙烯发生加成反应生成A为
,反应③为酯化反应,则试剂b为CH2=CHCH2OH.结合反应⑤产物结构可知该反应为取代反应,则反应④为甲苯与丙烯发生加成反应生成A为 ,对比B的前后物质的结构可知,反应⑥是羰基与氢气发生加成反应生成B为
,对比B的前后物质的结构可知,反应⑥是羰基与氢气发生加成反应生成B为 ,反应⑦为B中碳氧键断裂与CO发生加成反应生成布洛芬.
,反应⑦为B中碳氧键断裂与CO发生加成反应生成布洛芬.
(1)甲苯的分子式是为C7H8,布洛芬中官能团的名称是羧基,
故答案为:C7H8;羧基;
(2)试剂a的结构简式是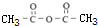 ,
,
故答案为: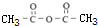 ;
;
(3)第③步的化学方程式是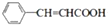 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$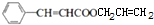 +H2O,
+H2O,
故答案为: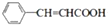 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$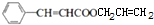 +H2O;
+H2O;
(4)第④~⑥中属于加成反应的有④⑥,
故答案为:④⑥;
(5)第⑤步的化学方程式是: ,
,
故答案为: ;
;
(6)布洛芬的一种同分异构体C与NaOH溶液共热反应,生成丙酸钠和化合物D,则C含有酯基,D含有羟基,而D的苯环上只有一条侧链且与浓硫酸共热不能发生消去反应,则D的结构简式是 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用有机物的结构进行分析解答,注意对题目信息的理解,侧重考查学生的分析推理能力,熟练掌握官能团的性质与转化,是对有机化学基础的综合考查.


科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| B. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| C. | 溴苯(溴单质):加NaOH溶液振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
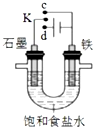
| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
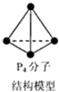
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )| A. | 未滴加NaOH溶液时溶液的pH小于相同条件下0.1mol•L-1 NaHSO4溶液的pH | |
| B. | pH为7时混合溶液中水的电离程度最大 | |
| C. | 当V(NaOH)=30mL时,c(NH3•H2O)+c(Na+)<2c(SO42-) | |
| D. | 滴加NaOH溶液的体积从30mL至40mL的过程中,$\frac{c(N{{H}_{4}}^{+})}{c({H}^{+})}$的值逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com