
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
分析 A、NaHCO3溶液显碱性,碳酸氢根离子的水解程度大于其电离程度;
B、据物料守恒分析;
C、据电荷守恒分析;
D、根据反应后的溶液显中性,氢离子与氢氧根离子物质的量相同进行计算.
解答 解:A、碳酸氢根离子的水解程度大于其电离程度,所以NaHCO3溶液中c(H2CO3)>c(CO32-),故A错误;
B、Na2CO3溶液中c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),NaClO溶液中c(Na+)=c(ClO-)+c(HClO),等浓度等体积的Na2CO3溶液与NaClO溶液混合后,碳酸钠中的c(Na+)是次氯酸钠中的2倍,所以2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3),故B正确;
C、据电荷守恒,室温下,KOH与苯酚混合pH=7的溶液中:c(K+)=c(C6H5O-)>c(H+)=c(OH-),故C错误;
D、水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液中c(OH-)=0.1mol/L,pH=2的硫酸中c(H+)=0.01mol/L,混合后溶液显中性,所以Va L×0.1mol/L=0.01mol/L×Vb L,Va:Vb=1:10,故D错误;
故选B.
点评 本题考查了离子浓度大小的比较以及pH的计算,做题时注意把握水的离子积常数随温度的变化而变化和溶液中的电荷守恒、物料守恒,题目难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.4.6g
B.4.2g
C.4.0g
D.3.2g
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的结构示意图为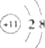 | |
| B. | 纯碱的化学式为Na2CO3 | |
| C. | 在酸性条件下,蔗糖水解的化学方程式为C12H20O11+H2O→2C6H12O6(葡萄糖) | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
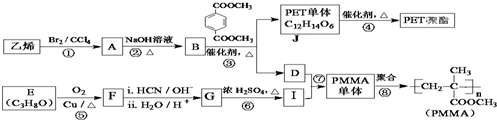
 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$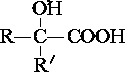 (R、R′代表烃基)
(R、R′代表烃基) $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.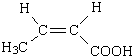 .
.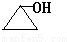 、
、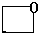 、
、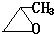 .
.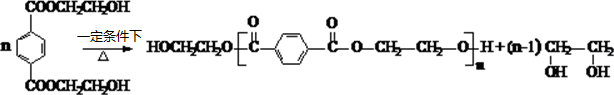 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com