
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: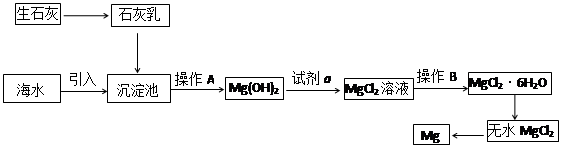
请回答下列问题:
⑴从离子反应的角度思考,在海水中加入石灰乳的作用是 。
⑵石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
⑶操作A是 , 操作B是 。
⑷无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
⑸海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。
(8分)⑴沉淀Mg2+ (或使Mg2+形成Mg(OH)2沉淀)⑵贝壳(或牡蛎壳等)
⑶过滤 ,加热浓缩(或蒸发结晶)
⑷MgCl2(熔融)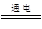 Mg + Cl2↑ ;制盐酸,循环使用
Mg + Cl2↑ ;制盐酸,循环使用
⑸海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高且成本低。
解析试题分析:(1)海水中含有镁离子,所以在海水中加入石灰乳的作用是沉淀Mg2+ (或使Mg2+形成Mg(OH)2沉淀)。
(2)海洋中含有大量的贝壳,而贝壳的主要成分是碳酸钙,所以生产生石灰的主要原料来源于海洋中的贝壳。
(3)氢氧化镁不溶于水,过滤即可。氯化镁易溶于水,要得到氯化镁晶体,需要加热浓缩(或蒸发结晶)。
(4)镁是活泼的金属,通过电解法冶炼,反应的化学方程式是MgCl2(熔融)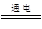 Mg + Cl2↑。从考虑成本和废物循环利用的角度,副产物氯气可以用制盐酸,循环使用。
Mg + Cl2↑。从考虑成本和废物循环利用的角度,副产物氯气可以用制盐酸,循环使用。
(5)由于海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高且成本低,所以要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁。
考点:考查海水提取镁的综合应用的判断
点评:该题是中等难度的试题,主要是以海水中提取镁为载体,重点考查学生对教材基础知识的了解掌握情况,意在巩固学生的基础,提高学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范实验设计能力,也有助于调动学生的学习兴趣和学习积极性。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
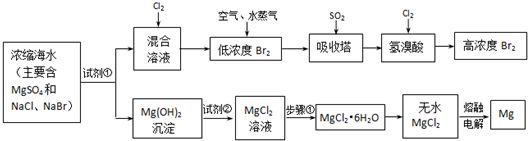
| ||
| ||
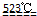 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑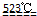 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑查看答案和解析>>
科目:高中化学 来源: 题型:

| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是:(四) | ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 是否正确 | 简述理由 | |
| 学生1的观点 | 否 否 |
海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 学生2的观点 | 否 否 |
能源消耗大,海水的综合利用低,成本高 能源消耗大,海水的综合利用低,成本高 |
| 学生3的观点 | 是 是 |
镁离子富集浓度高,成本低 镁离子富集浓度高,成本低 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
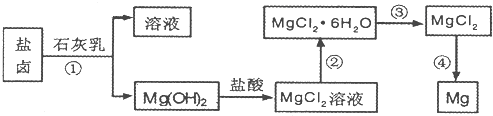
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com