
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
分析 A.电解质是指在水溶液或是熔融状态下能导电的化合物,据此回答判断;
B.胶体具有丁达尔效应,但是溶液没有;
C.能和酸反应生成盐和水的氧化物属于碱性氧化物;
D.根据分散质颗粒大小将分散系分为溶液、浊液和胶体.
解答 解:A.干冰的水溶液是碳酸溶液导电,不是本身导电,不属于电解质,液态氯化氢的水溶液能导电,是电解质,故A错误;
B.胶体具有丁达尔效应,但是溶液没有,用可见光束照射以区别溶液和胶体,故B正确;
C.Na2O、Fe2O3都是碱性氧化物,氧化铝为两性氧化物,故C错误;
D.根据分散质颗粒大小将分散系分为溶液、浊液和胶体,丁达尔效应是胶体的性质,故D错误;
故选B.
点评 本题考查了物质的分类及化学键的判断,中等难度,氧化铝属于两性氧化物是易错点,注意知识的归纳和梳理是关键.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:多选题
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | 1 mol液态水变成水蒸气时吸收44 kJ的热量 | |
| C. | 1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为-285.8 kJ•mol-1 | |
| D. | O2前面的表示参加反应的O2的分子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液的AG=1 | |
| B. | 常温下0.1 mol•L-1NaOH溶液的AG=12 | |
| C. | 酸性溶液的AG<0 | |
| D. | 常温下0.1 mol•L-1盐酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
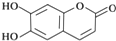
| A. | M的分子式是C9H6O4 | |
| B. | 1molM最多能与2molBr2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1molM与足量NaHCO3反应能生成2molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、I-、CO32-、Fe3+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Mg2+、Cl-、Ca2+ | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+═CaSO3↓ | |
| C. | NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
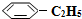 )可生产塑料单体苯乙烯(
)可生产塑料单体苯乙烯(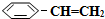 ),其原理反应是:
),其原理反应是: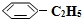 (g)?
(g)?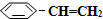 (g)+H2(g)△H=+125kJ•mol-1.
(g)+H2(g)△H=+125kJ•mol-1.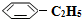 (g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
n(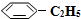 )/mol )/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(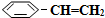 )/mol )/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
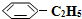 (g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动
(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动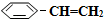 (g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下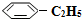 (g)和
(g)和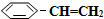 (g)的浓度c随时间t变化的曲线.
(g)的浓度c随时间t变化的曲线.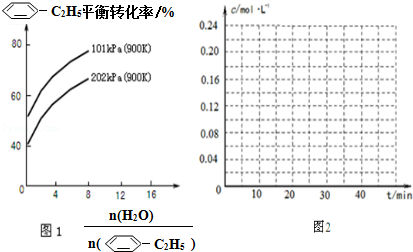
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
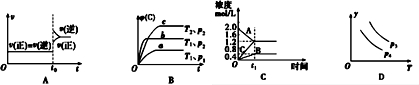
| A. | 对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 对于反应 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 该图象表示的化学方程式为:2A═B+3C | |
| D. | 对于反应 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com