
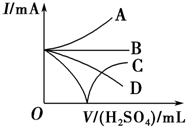
 向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:分析 ①二者反应生成硫酸钡和水;
②恰好生成硫酸钡时,导电能力为0,然后硫酸过量,导电性又增强.
解答 解:①向Ba(OH)2溶液中加入稀硫酸,反应生成硫酸钡和水,离子反应为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,
故答案为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;
②恰好生成硫酸钡时,导电能力为0,然后硫酸过量,导电性又增强,即导电性先减小酯0,然后又增大,只有C符合,故答案为:C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
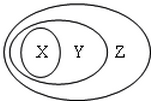 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 甲烷 | 烃 | 有机化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ MnO4- Na+ Cl- | B. | K+ Na+ NO3- CO32- | ||
| C. | Na+ H+ NO3- SO42- | D. | Fe3+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是七个基本物理量之一 | |
| B. | 测得1 mol某气体的体积为22.4L,则测定条件一定是标准状况 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线 | |
| D. | 凡是只能电离出H+这个阳离子的化合物都是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫 | |
| B. | 镀层破损后,马口铁(镀锡的铁)比白铁(镀锌的铁)更易腐蚀 | |
| C. | 加热后的纯碱水洗油污比冷碱水效果好 | |
| D. | FeCl3滴入沸水中,煮沸片刻得到红褐色胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g•L-1 | 1.6g/L |
| 排放标准 | pH=6~9 | 0.5mg/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
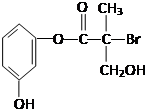
| A. | 该有机物与浓溴水可发生取代反应 | |
| B. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 该有机物能与Na、Na2CO3、NaHCO3溶液发生反应 | |
| D. | 该有机物经催化氧化后与银氨溶液水浴加热,可生成光亮的银镜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com