
| A. | 甲烷分子的球棍模型  | B. | 醛基的电子式  | ||
| C. | 乙酸的结构简式 C2H4O2 | D. | 乙烯的最简式为 CH2 |
分析 A. 为甲烷的比例模型,不是球棍模型;
为甲烷的比例模型,不是球棍模型;
B.醛基中O原子最外层达到8电子稳定结构,该电子式漏掉了O的2对未成键电子对;
C.C2H4O2为分子式,结构简式中需要标出官能团结构;
D.乙烯的分子式为C2H4,据此判断其最简式.
解答 解:A.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: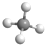 ,故A错误;
,故A错误;
B.醛基中碳原子含有一个孤电子,碳原子和氧原子形成两对共用电子对、和氢原子形成一对共用电子对,C、O误差都满足8电子稳定结构,其正确的电子式为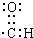 ,故B错误;
,故B错误;
C.乙酸分子中含有羧基,其正确的结构简式为:CH3COOH,故C错误;
D.最简式为分子中各原子的最简比,乙烯的分子式为C2H4,其最简式为CH2,故D正确;
故选D.
点评 本题考查常见化学用语的表示方法,题目难度中等,涉及电子式、球棍模型、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | O、P、Cl | D. | B、Mg、S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和NO2是主要的大气污染物 | |
| B. | 大气中的SO2和CO2溶于水形成酸雨 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 对煤燃烧后形成的烟气脱硫,目前主要用石灰法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热KJ/mol | 285.8 | 393.5 | 283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com