
 (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
分析 (1)由已知热化学方程式根据盖斯定律构造目标热化学方程式,据此计算△H的大小;
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
(3)①500s时,△c(N2O5)=5.00mol/L-3.52mol/L=1.48mol/L,结合v=$\frac{△c}{△t}$计算;
②可逆反应达到平衡状态时,生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值为化学平衡常数.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2生成物氨气的量增加,平衡正移,故T2<T1,故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
(3)①500s时,△c(N2O5)=5.00mol/L-3.52mol/L=1.48mol/L,则v(N2O5)=$\frac{△c}{△t}$═0.00296mol•L-1•s-1,由速率之比等于化学计量数之比可知,v(NO2)=0.00296mol•L-1•s-1×2=0.00592 mol•L-1•s-1;
故答案为:0.00592 mol•L-1•s-1;
②2N2O5(g)→4NO2(g)+O2(g),K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$,故答案为:K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$.
点评 本题主要考查了盖斯定律、化学反应速率的计算、外界条件对平衡的影响和化学平衡常数的书写,为高频考点,综合性较强,难度中等,注意化学反应原理的合理利用,加强计算能力的培养.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 按系统命名法,有机物  的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为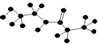 ,该有机物的结构简式为 ,该有机物的结构简式为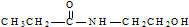 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
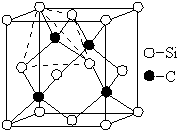 碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 草酸的体积/mL | 温度/℃ | 其它物质 |
| ① | 2mL | 20 | |
| ② | 2mL | 20 | 2滴饱和MnSO4溶液 |
| ③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温低压 | B. | 低温低压 | C. | 低温高压 | D. | 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作、现象 | 解释或结论 |
| A | 某溶液中先加稀HCl酸化,再加AgNO3,产生白色沉淀 | 原溶液有Cl-存在 |
| B | Cl2能使湿润的红布条褪色 | Cl2具有漂白性 |
| C | Na2SiO3溶液中通入CO2产生白色胶状沉淀 | H2CO3酸性大于H2SiO3 |
| D | 光照氯水有气泡产生 | 该气体一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com