
| A. | 消去→加成→取代 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
分析 由2-氯丙烷制得少量的CH3CHOHCH2OH,卤代烃发生消去反应生成碳碳双键,碳碳双键发生加成反应生成卤代烃,卤代烃发生水解反应生成醇,以此来解答.
解答 解:由2-氯丙烷制得少量的CH3CHOHCH2OH,2-氯丙烷先和NaOH的醇溶液共热发生消去反应生成CH2=CHCH3,丙烯和溴发生加成反应生成CH2BrCHBrCH3,CH2BrCHBrCH3再和NaOH的水溶液发生取代反应生成HOCH2CH(OH)CH3,
反应方程式为CH3CHClCH3+NaOH$→_{△}^{醇}$CH2=CHCH3+NaCl+H2O、CH2=CHCH3+Br2=CH2BrCHBrCH3、CH2BrCHBrCH3+2NaOH$→_{△}^{H_{2}O}$CH2OHCHOHCH3+2NaBr,
所以反应类型是消去反应、加成反应、水解反应或取代反应,
故选A.
点评 本题考查有机物的合成,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应的综合应用,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | K2O的电子式: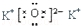 | |
| C. | 2-乙基-1,3-丁二烯分子的键线式: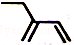 | |
| D. | 比例模型  可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
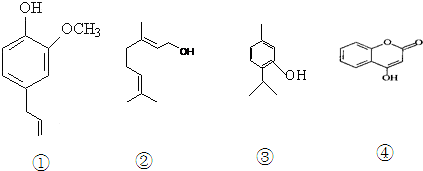
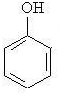 .
. 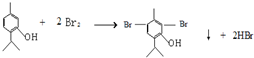 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
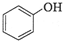
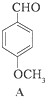 $→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$
$→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$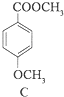
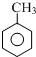 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$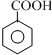
 .
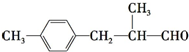
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
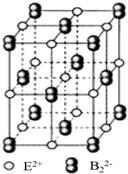 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.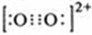 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com