
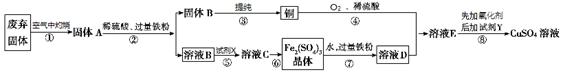
 2CuO + SO2 (2)蒸发浓缩;冷却结晶
2CuO + SO2 (2)蒸发浓缩;冷却结晶  2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。

科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu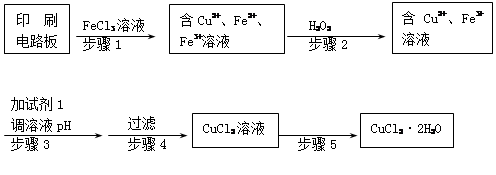
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
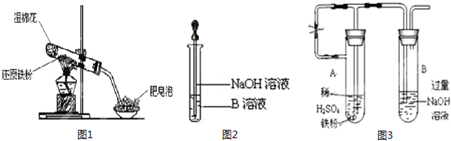
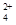 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。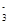 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
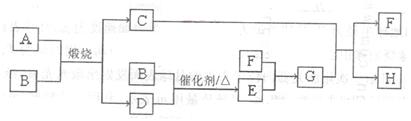
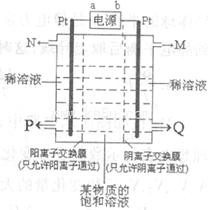
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

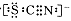
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
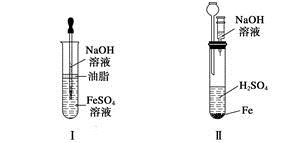
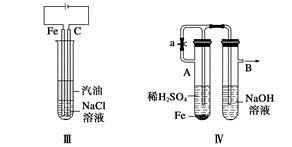
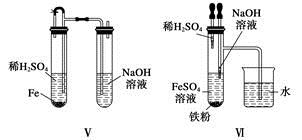
| A.Ⅰ、Ⅱ、Ⅳ |
| B.Ⅰ、Ⅱ、III、Ⅳ、Ⅵ |
| C.Ⅰ、III、Ⅴ |
| D.Ⅰ、Ⅱ、III、Ⅳ、Ⅴ、Ⅵ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com