
 £¬Ēėøł¾Ż»Æѧ·“Ó¦µÄÓŠ¹ŲŌĄķĶ¬“šĻĀĮŠĪŹĢā
£¬Ēėøł¾Ż»Æѧ·“Ó¦µÄÓŠ¹ŲŌĄķĶ¬“šĻĀĮŠĪŹĢā



 2SO3 (g)£»¦¤H£½ £198 kJ”¤mol-1(2·Ö)
2SO3 (g)£»¦¤H£½ £198 kJ”¤mol-1(2·Ö) O2 (g)
O2 (g)  SO3 (g)£»¦¤H£½ £99 kJ”¤mol-1
SO3 (g)£»¦¤H£½ £99 kJ”¤mol-1 2SO3£¬
2SO3£¬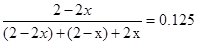 ½āÖ®µĆ£ŗx=0.8mol
½āÖ®µĆ£ŗx=0.8mol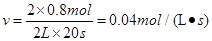
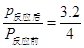 Ņņ“Ė·“Ó¦ŗóµÄŃ¹ĒæĪŖ·“Ó¦Ē°µÄ0.8±¶”£
Ņņ“Ė·“Ó¦ŗóµÄŃ¹ĒæĪŖ·“Ó¦Ē°µÄ0.8±¶”£ 2SO2 + O2 £¬
2SO2 + O2 £¬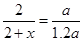 ½āÖ®µĆ£ŗx=0.4 ĖłŅŌ×Ŗ»ÆĀŹĪŖ40ØG
½āÖ®µĆ£ŗx=0.4 ĖłŅŌ×Ŗ»ÆĀŹĪŖ40ØG 2SO3 (g)£»¦¤H£½ £198 kJ”¤mol-1
2SO3 (g)£»¦¤H£½ £198 kJ”¤mol-1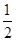 O2 (g)
O2 (g)  SO3 (g)£»¦¤H£½ £99 kJ”¤mol-1
SO3 (g)£»¦¤H£½ £99 kJ”¤mol-1


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 O2(g)=H2O(l) ¦¤H2£½£285.8 kJ”¤mol£1
O2(g)=H2O(l) ¦¤H2£½£285.8 kJ”¤mol£1| A£®¦¤H£½£«244.1 kJ”¤mol£1 |
| B£®¦¤H£½£488.3 kJ”¤mol£1 |
| C£®¦¤H£½£996.6 kJ”¤mol£1 |
| D£®¦¤H£½£«996.6 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H2(g)µÄČ¼ÉÕČȦ¤H£½£285£®8 kJ”¤mol£1 |
| B£®1molH2O(l)±ä³É1mo1H2O(g)£¬ĪüŹÕ88kJÄÜĮæ |
| C£®3H2(g)£«CO2(g)=CH3OH(l)£«H2O(l)¦¤H£½£«135£®9 kJ”¤mol£1 |
| D£®æÉŅŌŃ°ÕŅĢŲŹā“߻ƼĮŹ¹H2O·Ö½ā£¬Ķ¬Ź±·Å³öÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®21.44kJ | B£®600.20kJ | C£®21435.71kJ | D£®1965.10kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
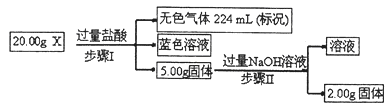
²éæ““š°øŗĶ½āĪö>>
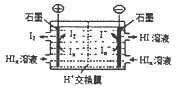
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

 CO(NH2)2 (l) + H2O (l)£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż£ØK£©ŗĶĪĀ¶Č£ØT / ”ę£©¹ŲĻµČēĻĀ£ŗ
CO(NH2)2 (l) + H2O (l)£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż£ØK£©ŗĶĪĀ¶Č£ØT / ”ę£©¹ŲĻµČēĻĀ£ŗ| T / ”ę | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 £¬ĻĀĶ¼£Ø1£©ŹĒ°±Ģ¼±Č£Øx£©ÓėCO2Ę½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©µÄ¹ŲĻµ”£¦ĮĖę×ÅxŌö“ó¶ųŌö“óµÄŌŅņŹĒ ”£
£¬ĻĀĶ¼£Ø1£©ŹĒ°±Ģ¼±Č£Øx£©ÓėCO2Ę½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©µÄ¹ŲĻµ”£¦ĮĖę×ÅxŌö“ó¶ųŌö“óµÄŌŅņŹĒ ”£


 £¬Ź¹ČĖĢåŃŖŅŗpH±£³ÖŌŚ7.35”«7.45£¬·ńŌņ¾Ķ»į·¢ÉśĖįÖŠ¶¾»ņ¼īÖŠ¶¾”£ĘäpHĖęc(HCO3-)”Ćc(H2CO3)±ä»Æ¹ŲĻµČēĻĀ±ķ£ŗ
£¬Ź¹ČĖĢåŃŖŅŗpH±£³ÖŌŚ7.35”«7.45£¬·ńŌņ¾Ķ»į·¢ÉśĖįÖŠ¶¾»ņ¼īÖŠ¶¾”£ĘäpHĖęc(HCO3-)”Ćc(H2CO3)±ä»Æ¹ŲĻµČēĻĀ±ķ£ŗ| c(HCO3-)”Ćc(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā

 CO2(g)£«H2(g)£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ
CO2(g)£«H2(g)£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
 CH3OH(g) ”÷H1=£116 kJ”¤mol£1
CH3OH(g) ”÷H1=£116 kJ”¤mol£1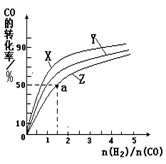

 O2(g)=CO2(g) ”÷H2=£283 kJ”¤mol£1
O2(g)=CO2(g) ”÷H2=£283 kJ”¤mol£1 O2(g)=H2O(g) ”÷H3=£242 kJ”¤mol£1
O2(g)=H2O(g) ”÷H3=£242 kJ”¤mol£1²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com