
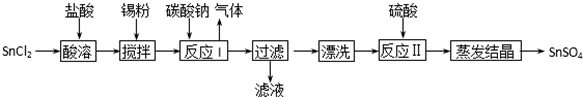
分析 SnCl2能水解生成碱式氯化亚锡,用盐酸溶解,防止其水解,在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+,加入锡粉主要是防止在溶解时被空气中氧气氧化,过滤出锡粉,得到SnCl2溶液,碳酸钠与SnCl2反应生成氧化亚锡、二氧化碳和氯化钠,过滤得到SnO,再利用SnO与硫酸反应得到SnSO4溶液,经过蒸发浓缩、冷却结晶等操作得到SnSO4是晶体,以此解答该题.
解答 解:SnCl2能水解生成碱式氯化亚锡,用盐酸溶解,防止其水解,在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+,加入锡粉主要是防止在溶解时被空气中氧气氧化,过滤出锡粉,得到SnCl2溶液,碳酸钠与SnCl2反应生成氧化亚锡、二氧化碳和氯化钠,过滤得到SnO,再利用SnO与硫酸反应得到SnSO4溶液,经过蒸发浓缩、冷却结晶等操作得到SnSO4是晶体,
(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入硫酸,使该平衡向左移动,抑制Sn2+水解,由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还除去酸溶时产生的少量Sn4+、防止Sn2+被氧化,
故答案为:抑制Sn2+水解;防止Sn2+被氧化;
(2)碳酸钠与SnCl2反应生成氧化亚锡、二氧化碳和氯化钠,反应的化学方程式为:SnCl2+Na2CO3=SnO+CO2↑+2NaCl,
故答案为:SnCl2+Na2CO3=SnO+CO2↑+2NaCl;
(3)已知:Ksp[Sn(OH)2]=1.0×10-26,若溶液中c(Sn2+)=1.0mol•L-1,则应满足c(OH-)<$\sqrt{\frac{1.0×1{0}^{-26}}{1.0}}$=1.0×10-13(mol/L),即pH<1,
故答案为:小于1;
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:2Sn2++2H2O2+4H+=2Sn4++4H2O.
点评 本题考查制备实验方案,涉及对工艺流程的理解、对操作的分析评价、物质的分离提纯、阅读题目获取信息的能力等,是对学生综合能力的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2CO3溶液中BaSO4沉淀转化为BaCO3沉淀 | |
| B. | 升高温度,化学平衡发生移动是因为平衡常数改变 | |
| C. | 持续加热,水中MgCO3逐渐转化为更难溶的Mg(OH)2 | |
| D. | 改变一个影响因素使化学平衡发生移动,则平衡常数K值一定变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
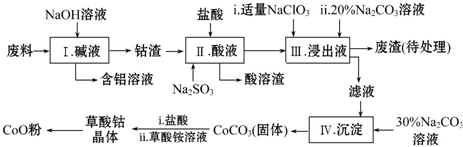
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)→C(金刚石)△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com