
| A. | 乙烷 | B. | 乙烯 | C. | 四氯化碳 | D. | 甲苯 |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它在一定条件下可能发生的反应( )
,它在一定条件下可能发生的反应( )| A. | ①③④⑤⑥⑦⑧ | B. | ①③④⑤⑦⑧ | C. | ①③⑤⑥⑦ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
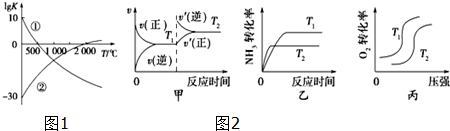
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化汽油 | B. | 直馏汽油 | C. | 甲苯 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键; 分子间作用力; 非极性键 | |
| B. | 氢键; 氢键; 极性键 | |
| C. | 氢键; 极性键; 分子间作用力 | |
| D. | 分子间作用力; 氢键; 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
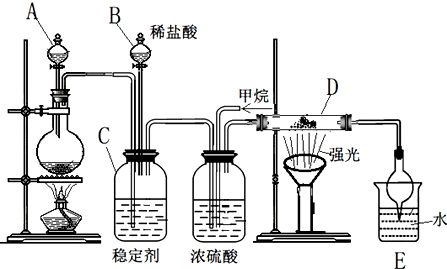
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 2.0mol•L-1 | C. | 1.5 mol•L-1 | D. | 1.0mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com