
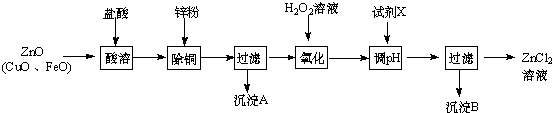
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应;
分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应; 分子间发生缩聚反应生成聚乳酸和水;
分子间发生缩聚反应生成聚乳酸和水; 分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为
分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为 ;
; 分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:
分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为: ;
; ;
; ;
;

科目:高中化学 来源: 题型:
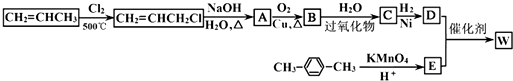
| 过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O=[Al(OH)4]-+4NH4+ |
| B、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| C、大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、在酸碱中和滴定实验中,滴定管都需润洗,否则引起误差 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
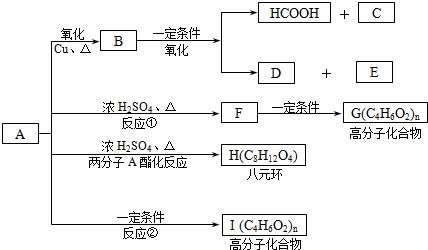
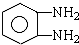 )缩聚生成一种合成纤维:
)缩聚生成一种合成纤维:查看答案和解析>>
科目:高中化学 来源: 题型:
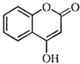 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: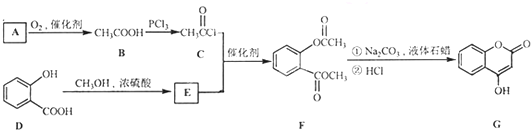
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,4.6g NO2含有0.2NA个氧原子 |
| B、0.1mol Na2O2固体中含有离子总数为0.4NA |
| C、标准状况下2.24L Cl2与足量的铁充分反应,转移电子数为0.3NA |
| D、等物质的量的NO和CO2所含分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com