
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | V(H2SO4) mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 35 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
分析 (1)根据反应前后溶液温度变化分析判断;
(2)实验1、2硫酸的浓度不同,实验3、4反应的温度不同,通过对比实验得出结论;
(3)铁的表面有大量气泡,说明在铁极上生成氢气,铁为原电池的正极,金属做负极比铁活泼.
解答 解:(1)图表数据分析,反应前后温度升高,说明反应是放热反应,反应物能量高于生成物,故答案为:高;
(2)实验1、2硫酸的浓度不同,对比二者可知反应物浓度越大,反应速率越快,实验3、4反应的温度不同,对比二者可知反应温度越高,反应速率越快,
故答案为:反应物浓度越大,反应速率越快;反应温度越高,反应速率越快;
(3)铁的表面有大量气泡,说明在铁极上生成氢气,铁为原电池的正极,电极反应式为:2H++2e-=H2↑,原电池活泼金属作负极,较不活泼金属作正极,所以该金属的金属活动性比铁强,
故答案为:强;2H++2e-=H2↑.
点评 本题考查较为综合,涉及化学反应与能量以及化学反应速率的探究,题目难度不大,注意把握实验方法、原理.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题

 )
) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
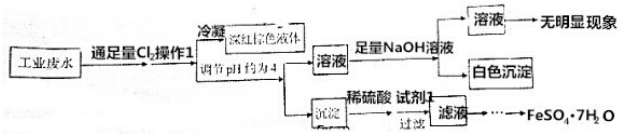
| A. | 该工业废水中肯定存在Cu2+、I- | |
| B. | 若废水中存在NO3-,则肯定存在Fe3+ | |
| C. | 操作1为鼓入热空气,试剂1为Fe | |
| D. | 为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2 | ||
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑ | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 消耗0.1032mol•L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX<H2Y<ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 离子半径:X->Y2->Z3- | D. | 原子序数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com