
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g) W(s)+3H2O(g)
W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为________。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2∶3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为________反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温 度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为_____________;
580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为__________。
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2H2(g)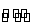 W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
WO2(g)+2H2(g)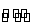 W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s)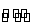 WO2(g)的ΔH=______。
WO2(g)的ΔH=______。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2(g)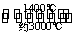 WI4(g)。下列说法正确的有________。
WI4(g)。下列说法正确的有________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
【解析】(1)化学平衡常数表达式中不出现固体和纯液体;
(2)根据氢气和水蒸气的体积比可以求出反应的氢气的体积和反应前的氢气的体积,从而可以计算氢气的转化率,氢气与水蒸气的体积比减小说明平衡正向移动;
(3)根据表格中每一个温度段的主要物质可以判断反应方程式、固体产物以及消耗氢气的量;
(4)反应1-反应2即可得目标反应;
(5)工业生产中向灯泡内充入碘单质之后,它与灯泡内壁上的钨在一定温度下反应生成碘化钨,碘化钨在灯丝上分解生成钨单质,反应体系为密闭体系,反应又是可逆反应,因此碘单质可以循环利用。
答案:(1)K=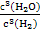 (2)60% 吸热
(2)60% 吸热
(3)2WO3+H2 W2O5+H2O W2O5、WO2 1∶1∶4
W2O5+H2O W2O5、WO2 1∶1∶4
(4)+203.9 kJ·mol-1 (5)a、b


科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol/LNH4Cl 溶液与2 L 0.25 mol/LNH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) >c(HCO3-) >c(CO32-)>c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A.①②④ B.①③⑤ C.③⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO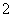
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为相互串联的甲、乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发现石墨电极附近先变红。请回答:
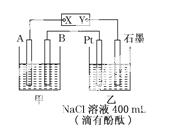
(1)电源X极为______极(填“正”或“负”),乙池中Pt电极上的电极反应式为______。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为______,电路中通过的电子为______mol。
(3)若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)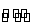 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量akJ |
| ② | 2 | 3 | 0 | 放出热量bkJ |
| ③ | 2 | 6 | 0 | 放出热量ckJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于吸热反应的是
A.CaO+H2O = Ca(OH)2
B.2Na+O2  Na2O2
Na2O2
C.Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
D.右图所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氮原子构成的分子。下列有关这两种粒子的说法不正确的是
A.“四中子” 粒子不显电性
B.被称为零号元素是因为该粒子不含质子
C.相同质量的N2和N4所含原子个数比为1∶2
D.第二种粒子的化学式为N4,与N2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.146C核素中的中子数为8 D.14CO2的摩尔质量为46
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com