
【题目】在某温度下2L密闭容器中,3种气体加入起始状态和平衡状态时的物质的量(n)如下表所示:
X | Y | W | |
起始状态(mol) | 2 | 1 | 0 |
平衡状态(mol) | 1 | 0.5 | 1.5 |
下列有关说法正确的是( )
A.该温度下,该反应的平衡常数K=9
B.升高温度,若W的体积分数减小,此反应△H>0
C.该温度下,该反应的方程式为 2X(g)+Y(g)3W(g)
D.增大压强,正、逆反应速率都增大,平衡向正反应方向移动
【答案】C
【解析】解:由表中数据可知,△n(X)=1mol、△n(Y)=0.5mol、△n(W)=1.5mol,物质的量变化量之比等于化学计量数之比,所以,△n(X):△n(Y):△n(W)=1mol:0.5mol:0.5mol=2:1:3,反应方程式为2X+Y3W,
A.反应方程式为2X+Y3W,反应前后气体的物质的量相同,可以利用物质的量代替浓度计算平衡常数,所以平衡常数k= ![]() =
= ![]() =6.75,故A错误;
=6.75,故A错误;
B.升高温度,若W的体积分数减小,说明平衡逆向移动,则正反应放热,此反应△H<0,故B错误;
C.由以上分析可知该温度下,该反应的方程式为 2X(g)+Y(g)3W(g),故C正确;
D.方程式为 2X(g)+Y(g)3W(g),反应前后体积不变,增大压强,平衡不移动,故D错误.
故选C.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 阿伏加德罗常数是6.02×1023 B. 32 g O2所含O2的物质的量为1摩
C. 摩尔可表示物质的质量、数量 D. 1molClO2含有NA个氧分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学﹣﹣选修化学与技术] 高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示. ![]()
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示: 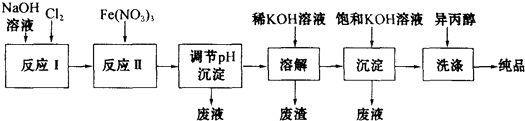
①反应Ⅰ的化学方程式为 .
②反应Ⅱ的离子方程式为 .
③加入饱和KOH溶液的目的是 .
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为、 , 、 .
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 .
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性 电池的放电曲线,由此可得出的高铁电池的优点有 , . 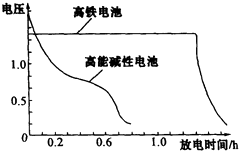
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.已知:在实验室可用钙盐制取CaO28H2O,再经脱水制得CaO2 . 其制备过程如下: 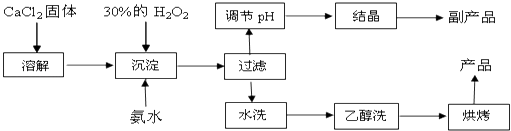
(1)“溶解”过程需要的玻璃仪器有;“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是;为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加(填试剂),无明显现象说明“水洗”合格.
(2)“沉淀”时发生反应的离子方程式为;该制法的副产品为(填化学式);若称取11.1g无水CaCl2 , 理论上应该量取质量分数30%、密度1.1g/cm3的H2O2溶液mL.
(3)测定产品中CaO2的含量的实验步骤是: 第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.【已知:I2+2S2O32﹣→2I﹣+S4O62﹣(无色)】
①第三步中说明反应恰好完全的现象是 .
②CaO2的质量分数为(用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“偏高”、“偏低”、“无影响”、“不能确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质制备的说法正确的是( )
A.玻璃是以石灰石、纯碱、石英在玻璃熔炉中高温熔融制得的
B.工业上将氯气通入澄清石灰水中制取漂白粉
C.用焦炭在高温下还原二氧化硅可得到纯硅
D.高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲曲线表示在最适温度下,某种酶促反应速率与反应物浓度之间的关系。其余两条曲线分别表示该酶促反应的反应速率受温度和pH的影响情况。回答下列问题:
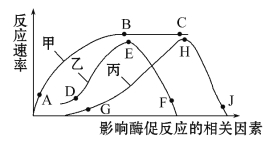
(1)甲曲线中,若在A点适当提高温度,反应速率将会_____________________;在B点适当增加酶的浓度,反应速率将会__________________。
(2)丙曲线中,H点代表该酶的_____________________。
(3)若想要短期保存该酶,应选择曲线中的________点所对应的温度。
(4)探究温度对酶活性的影响时,通常选择_________________________(填“淀粉酶”或“过氧化氢酶”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH![]() 、CH3、CH
、CH3、CH![]() 都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH
都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH![]() 中四个原子是共平面的,三个键角相等,则键角应是________。
中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N![]() 叫做叠氮离子,请写出3种由三个原子构成的含有与N
叫做叠氮离子,请写出3种由三个原子构成的含有与N![]() 的电子数相同的粒子的化学式__________、__________、__________。
的电子数相同的粒子的化学式__________、__________、__________。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2molL﹣1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度所示,下列说法正确的是( ) 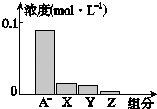
A.HA为强酸
B.该混合溶液pH=7.0
C.该混合溶液中:c(A﹣)+c(Y)=c(Na+)
D.图中X表示HA,Y表示OH﹣ , Z表示H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com