
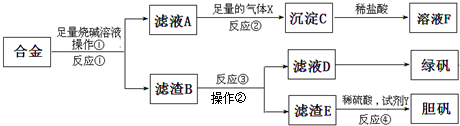
Ϊ̽����ҵ����������ͭ�Ͻ���ϵ������ã���ͬѧ��Ƶ�ʵ�鷽�����£�

��ش�
��1�������ٵ������� ��
��2��д����Ӧ�ٵĻ�ѧ����ʽ ��
��Ӧ�ڵ����ӷ�Ӧ����ʽ ��
��3�����ʵ�鷽���������ҺD�к��еĽ������ӣ��Լ���ѡ�� ��
��4��������E�м���ϡ������Լ�Y�Ƶ���������һ����ɫ��ѧ���գ��Լ�YΪ��ɫҺ�壬��Ӧ�ܵ��ܻ�ѧ����ʽ�� ��
��5����ͬѧ�ڼ�ͬѧ�����Ļ��������������B���Ʊ� FeCl3•6H2O���壬�������еμ�����ʱ�����ַ�Ӧ���ʱ�ͬŨ�������봿���۷�ӦҪ�죬��ԭ���� ���������Ȼ�����Һ�ü���Ũ�������½ᾧ���Ƶ�FeCl3•6H2O���壬������ֱ�������ᾧ�ķ������Ƶþ���������� ���������������������������� ����������������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ʵ���� | �� | �� | �� | �� |
| ϡ�������/mL | 100 | 200 | 300 | 400 |
| ʣ���������/g | 9.0 | 4.8 | 0 | 0 |
| NO���/L | 1.12 | 2.24 | 3.36 | V |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ̽����ҵ����������ͭ�Ͻ���ϵ������ã�ijͬѧ��Ƶ�ʵ�鷽�����£�
��ش�
��1���������õ��IJ��������� ��
��2��д����Ӧ�ٵĻ�ѧ����ʽ ����
��Ӧ�ڵ����ӷ�Ӧ����ʽ ��
��3��������E�м���ϡ������Լ�Y�Ƶ���������һ����ɫ��ѧ���գ��Լ�YΪ��ɫҺ�壬��Ӧ�ܵ��ܻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ����10�·��¿���ѧ�Ծ� ���ͣ�ʵ����
Ϊ̽����ҵ����������ͭ�Ͻ���ϵ������ã�ijͬѧ��Ƶ�ʵ�鷽�����£�

��ش�
��1���������õ��IJ��������� ��
��2��д����Ӧ�ٵĻ�ѧ����ʽ ����
��Ӧ�ڵ����ӷ�Ӧ����ʽ ��
��3��������E�м���ϡ������Լ�Y�Ƶ���������һ����ɫ��ѧ���գ��Լ�YΪ��ɫҺ�壬��Ӧ�ܵ��ܻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com