
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体 C.硫酸钠溶液 D.纯碱溶液
II、合成氨的流程示意图如下:
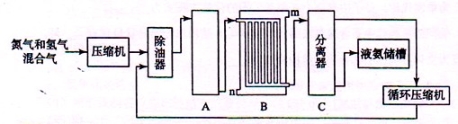
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3) 设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) 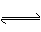 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
Ⅰ、AC (2分)
Ⅱ、(1) 液化、分馏 ; (1分) 与碳反应除去CO2 (1分)
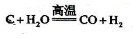 (1分)
(1分)  (1分)
(1分)
(2) 合成塔 (1分)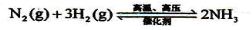 (1分)
(1分)
(3)冷却塔 (1分) n (1分)
高温气体由冷却塔的上端进入,冷却水从下端进入,逆向冷却效果好。(2分)
(4)将液氨与未反应的原料气分离。 (1分)
(5)13.8 (2分)
【解析】
试题分析:I.过量氨水与Cu2+反应生成[Cu(NH3)2]2+、硫酸钠溶液与Cu2+不反应。
Ⅱ⑴从空气中分离出氮气的方法:①先通过降温将空气液化,然后再升温分馏得氮气,②将空气与碳反应,然后再除去CO2得氮气;C、CH4均能与水蒸气反应制取氢气。
⑵工业上合成氨( )的设备为合成塔;
)的设备为合成塔;
⑶从合成塔出来的混合气(N2、H2、NH3)通过冷却塔使氨气冷凝从混合气中分离出来;冷却水要从下口(n)进入,高温气体由冷却塔的上端进入,实现逆向冷却效果好。
⑷设备C能将液氨与未反应的原料气分离出来,同时再将未反应的原料气压缩到合成塔中循环利用。
⑸据题意,要使反应正向进行(除去CO),则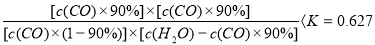 ,解得
,解得 。
。
考点:本题考查合成氨工业的设备与原理及化学平衡常数的计算与应用。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(5分)在固定容积的密闭容器中,有可逆反应nA(g)+mB(g) pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+O2(g)=2H2O(g) △H2
C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )
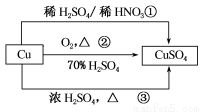
A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:选择题
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01 mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01 mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
[化学——选修3: 物质结构与性质](15分)
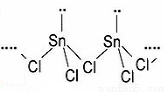
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。

(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如右图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度 为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀)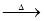 CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)生成0.5mol还原产物时,转移的电子的物质的量为 mol。
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )
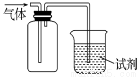
选项 | 试剂 | 现象 | 结 论 |
A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
C | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 |
D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性,没有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com