
由CH4和O2组成的混合气体,标准状况下的密度为1g·L-1,则该混合气体中CH4和O2的体积比为
A.2:1 B.1:2 C.2:3 D.3:2
科目:高中化学 来源:2017届内蒙古高三上模拟三化学试卷(解析版) 题型:选择题
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2下列有关说法正确的是
Li2O2下列有关说法正确的是
A.充电时,多孔金制成的电极外接电源负极
B.放电时,Li+从负极向正极移动
C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
D.该电池可使用含Li+的水溶液作电解质溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
①根据酸分子中含有氢原子的个数将酸分为一元酸、二元酸等
②根据反应中是否有离子参加将化学反应分为离子反应和非离子反应
③根据丁达尔效应可将分散系分为胶体、溶液和浊液
④根据电解质在水溶液或熔融状态下能否完全电离,将电解质分为强电解质和弱电解质
⑤根据反应的热效应将化学反 应分为放热反应和吸热反应
A.②③ B.②④⑤ C.①②④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2,+4价的Pb还原成+2价的Pb;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是
A.1:1混合的Pb3O4、PbO B.1:2混合的PbO2、Pb3O4
C.1:4:1混合的PbO2、Pb3O4、PbO D.1:1:1混合的PbO2、Pb3O4、PbO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
下列反应中,1mol H2O得到1mol e-的是
A.2Na+2H2O=2NaOH+H2↑ B.3NO2+H2O=2HNO3+NO↑
C.Cl2+H2O=HCl+HClO D.2F2+2H2O=4HF+O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
将一小块金属钠长期露置于空气中,最终的产物是
A.Na2CO3 B.Na2O C.NaOH D.Na2CO3·10H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:选择题
下列叙述中不正确的是
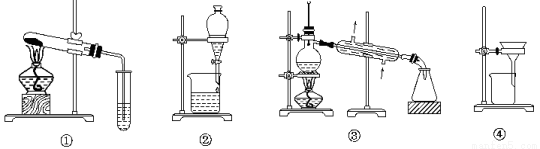
A.可用装置①鉴别碳酸钠和碳酸氢钠
B.可用装置②分离汽油和水的混合物
C.可用装置③从海水中蒸馏得到淡水
D.可用装置④把胶体粒子从分散系中分离出来
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水时电离方程式为:H3PO2 H++H2PO22-
H++H2PO22-
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
下图表示氮及其化合物在一定条件下的转化关系:
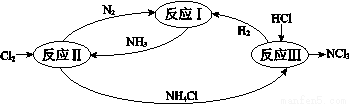
(1)根据反应I,在500℃、20MPa时,将N2和H2通入到 体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
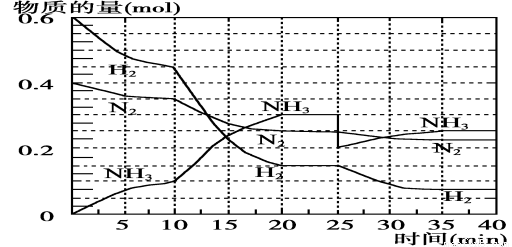
(1)10 min内用NH3表示该反应的平均速率,v(NH3)= 。
(2)在10~20min内NH3浓度变化的原因可能是 (填字母)。
a.加了催化剂
b.降低温度
c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是_______(填字母)。
a.3v(H2)正 = 2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d. N2、H2、NH3的分子数之比为1∶3∶2
(4)第一次平衡时,平衡常数K1= (用数学表达式表示)。
(5)反应I:N2(g)+3H2(g) 2NH3(g) ΔH=–92.4 kJ•mol-1
2NH3(g) ΔH=–92.4 kJ•mol-1
如图所示反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是____________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由_______ 。

(6)反应II其中一步反应为
2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJ•mol-1
已知: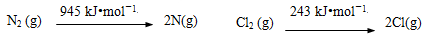
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_________ kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com