
| ||
| 54 |
| 102 |
| 9b |
| 17 |
| 9b |
| 17 |
| ||
| ag |
| 900b |
| 17a |
| ||
| 900b |
| 17a |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
 如图的电解池中,a、b、c、d都是石墨电极,通电一段时间后,a、b、c、d各电极上生成物物质的量之比是( )
如图的电解池中,a、b、c、d都是石墨电极,通电一段时间后,a、b、c、d各电极上生成物物质的量之比是( )| A、2:2:4:1 |
| B、1:1:2:1 |
| C、2:4:4:1 |
| D、2:1:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验过程 | 实验现象 | |
| Ⅰ | 通入一段时间N2加热 | A中固体变为红棕色,B中有白色沉淀生成,D试管中有无色液体生成 |
| Ⅱ | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| Ⅲ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| Ⅳ | 将重所得溶液滴入D试管中 | 混合溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
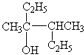
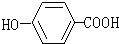
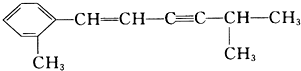 该分子中最多有
该分子中最多有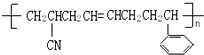 ,这三种单体的结构简式分别是
,这三种单体的结构简式分别是查看答案和解析>>
科目:高中化学 来源: 题型:
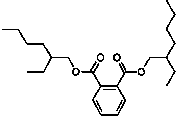 受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )
受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )| A、DEHP是芳香族化合物 |
| B、DEHP是酯类物质 |
| C、DEHP分子中共有5个双键 |
| D、DEHP分子中至少有8个碳原子在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强p(Pa) | 2×105 | 5×105 | 1×106 |
| c(A)mol/L | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com