
(14分) 碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(14分)(1) AD (2分)
(2)- 41.2KJ/mol (2分)
(3)CH3OH+H2O-6e-=CO2↑+6H+ (3分)
(4) ①< (2分) ② 0.36 (2分) ③不变 (3分)
解析试题分析:(1)A、升高温度,平衡正向移动,氢气的产率增大,正确;B、碳为固体,增加碳的量对平衡无影响,氢气的产率不变,错误;C、加入催化剂对平衡无影响,氢气的产率不变,错误;D、用CO吸收剂除去CO,生成物的浓度减小,平衡正向移动,氢气的产率增大,正确,答案选AD;、
(2)C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1, ①
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1, ①
C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1 ②
2CO(g) △H=+172.5kJ?mol-1 ②
根据盖斯定律,
CO(g)+H2O(g) CO2(g)+H2(g)的△H=①-②="131.3" kJ?mol-1-172.5kJ?mol-1=- 41.2KJ/mol;
CO2(g)+H2(g)的△H=①-②="131.3" kJ?mol-1-172.5kJ?mol-1=- 41.2KJ/mol;
(3)稀硫酸作电解质,甲醇为燃料,则负极是甲醇发生的氧化反应,生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2↑+6H+ ;
(4)① CO(g)+H2O(g) CO2(g)+H2(g)为放热反应,所以降低温度,平衡正向移动,达新平衡前v(逆)<v(正);
CO2(g)+H2(g)为放热反应,所以降低温度,平衡正向移动,达新平衡前v(逆)<v(正);
② CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
开始时(mol/L) 0.08 0.08
平衡时(mol/L) 0.05 0.05 0.03 0.03
所以化学平衡常数K=0.032/0.052=0.36;
③该反应为反应前后气体的物质的量不变的可逆反应,所以充入物质的物质的量对应成比例时,达到的平衡是等效平衡,开始时CO与H2O物质的量比是1:1,再充入0.1mol CO和0.1mol H2O(g),CO与H2O物质的量比仍是1:1,所以再达平衡时与原平衡等效,CO的体积分数不变。
考点:考查化学平衡理论的应用,电化学原理的应用,盖斯定律的应用


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:单选题
C、CO、CH4、C2H5OH是常用的燃料,他们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是:( )
A.C B. CO C. CH4 D. C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:断开1molN≡N需要吸收akJ热量,断开1molH—H需要吸收bkJ热量,断开1molN—H需要吸收ckJ热量。向某密闭容器中通入1molN2和3molH2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)(放热反应)。下列描述中正确的是
2NH3(g)(放热反应)。下列描述中正确的是
| A.N2和H2具有的总能量一定比NH3具有的总能量低 |
| B.a、b、c三者的关系为:a+3b<2c |
| C.向密闭容器中通入1molN2和3molH2,反应放出的热量必为(6c―a―3b)kJ |
| D.形成1molN—H会放出ckJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某反应过程能量变化如图所示,下列说法正确的是
| A.反应过程a有催化剂参与 |
| B.该反应为放热反应,热效应等于ΔH |
| C.改变催化剂,可改变该反应的活化能 |
| D.有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ/mol
③H2O(g)=H2O(l) △H=-44kJ/mol。下列说法不正确的是
| A.等物质的量的CH4参加反应,反应①②转移的电子数相同 |
| B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-530 kJ/mol |
| C.0.2 mol CH4还原NO2至N2,且生成H2O(g)放出的热量为164.6 kJ |
| D.若用4.48 L(标准状况)CH4还原NO2至N2且生成H2O(g),整个过程中转移电子1.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列热化学方程式:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
Fe2O3(s)+ 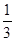 CO(g)
CO(g)
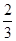 Fe3O4(s)+
Fe3O4(s)+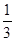 CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/mol
Fe3O4(s)+ CO(g) 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能、太阳能的转换),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
| A.煤、石油和天然气都属于碳素燃料 |
| B.发展太阳能经济有助于减缓温室效应 |
| C.太阳能电池可将太阳能直接转化为电能 |
| D.目前研究菠菜蛋白质“发电”不属于“太阳能文明” |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应过程中的能量变化与下图一致的是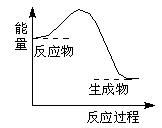
A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.C+CO2 2CO 2CO |
C.CaCO3 CaO+CO2↑ CaO+CO2↑ |
D.C+H2O CO+H2 CO+H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com