
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

| 苯 | 溴 | 溴苯 |
密度 | | | |
沸点 | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入![]() 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、![]() 的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是___![]() 填入正确选项前的字母
填入正确选项前的字母![]() ;
;
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是________。
a.25 mL ![]()
![]()
![]()
【答案】HBr 吸收HBr和Br2,防止污染 除去未反应的Br2 干燥 苯 c b
【解析】
a中,Fe和溴发生氧化反应生成溴化铁,在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,HBr遇水蒸气生成氢溴酸小液滴而产生白雾,冷凝管有冷凝回流作用,提高反应物的利用率;生成的HBr和挥发出的溴通过导气管进入d中和氢氧化钠反应生成钠盐,结合溴苯的性质分析解答。
(1)在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,HBr遇水蒸气产生白雾,所以产生白雾的是HBr;HBr、Br2蒸气不能直接排空,否则污染大气,用碱液吸收,所以d的作用是吸收HBr和Br2,故答案为:HBr;吸收HBr和Br2,防止污染;
(2)②溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,故答案为:除去未反应的Br2;
③无水氯化钙能吸收水分,起到干燥剂的作用,故答案为:干燥;
(3)溴苯能溶于苯中,所以经以上分离操作后,溴苯中的主要杂质是苯,二者互溶应该采用蒸馏方法分离,故答案为:苯;c;
(4)操作过程中,在a中加入15mL无水苯,然后又向a中加入10mL水,在b中小心加入4.0mL液态溴,反应过程中也加入到a中,所以a的容积最适合的是50mL,故答案为:b。


科目:高中化学 来源: 题型:
【题目】氢、碳和氯的单质及化合物在生产和生活中有广泛用途。
(1)H2(g)+Cl2 (g) =2HCl(g) ΔH反应的能量变化示意图如图1所示,其中436kJ/mol表示的含义是_____,由图计算ΔH=____kJ/mol。
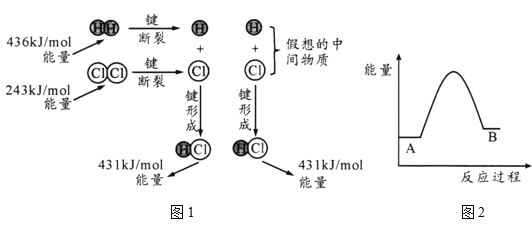
(2)金刚石、石墨的燃烧热分别为395.4kJ/mol和393.5kJ/mol。图2是两者相互转化的能量变化示意图,A表示的物质为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是

A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,盐桥中装有含琼胶的KCl饱和溶液。下列有关叙述中正确的是( )
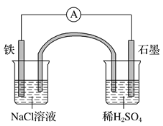
A.Fe作正极,发生氧化反应B.工作一段时间后,两烧杯中溶液pH均不变
C.负极反应:2H++2e-=H2↑D.工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如下转化:
![]()
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A.若X为![]() 或
或![]() ,则A为硝酸
,则A为硝酸
B.若X为![]() 或
或![]() ,则A为硫酸
,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/ kJmol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)![]() N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。

(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com