
 .
. .
. .
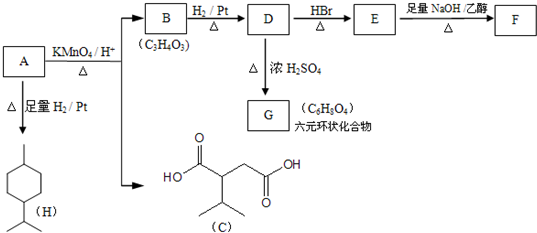
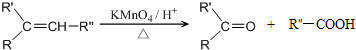
. 分析 由A→H的转化加氢,有机物分子的碳链骨架没有变化,可知A分子中含有一个六元环,结合A的分子式C10H16可知还应含有两个不饱和度,再根据题中信息以及C的结构简式、B的分子式可推出A的结构简式为 ,则B的结构简式为
,则B的结构简式为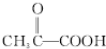 ,B→D加氢,属于加成反应,则D为乳酸
,B→D加氢,属于加成反应,则D为乳酸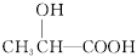 ,由E→F的条件“氢氧化钠的醇溶液加热”,应为卤代烃的消去,逆推可知D→E发生取代反应,溴原子取代了乳酸分子中的羟基,则E、F的结构简式分别为
,由E→F的条件“氢氧化钠的醇溶液加热”,应为卤代烃的消去,逆推可知D→E发生取代反应,溴原子取代了乳酸分子中的羟基,则E、F的结构简式分别为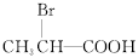 和
和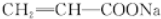 ,G为两个D发生分子内脱水形成,结构简式为
,G为两个D发生分子内脱水形成,结构简式为 ,据此答题.
,据此答题.
解答 解:由A→H的转化加氢,有机物分子的碳链骨架没有变化,可知A分子中含有一个六元环,结合A的分子式C10H16可知还应含有两个不饱和度,再根据题中信息以及C的结构简式、B的分子式可推出A的结构简式为 ,则B的结构简式为
,则B的结构简式为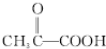 ,B→D加氢,属于加成反应,则D为乳酸
,B→D加氢,属于加成反应,则D为乳酸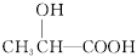 ,由E→F的条件“氢氧化钠的醇溶液加热”,应为卤代烃的消去,逆推可知D→E发生取代反应,溴原子取代了乳酸分子中的羟基,则E、F的结构简式分别为
,由E→F的条件“氢氧化钠的醇溶液加热”,应为卤代烃的消去,逆推可知D→E发生取代反应,溴原子取代了乳酸分子中的羟基,则E、F的结构简式分别为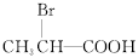 和
和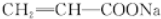 ,G为两个D发生分子内脱水形成,结构简式为
,G为两个D发生分子内脱水形成,结构简式为 ,
,
(1)根据上面的分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)B→D为羰基与氢气发生的加成反应,故答案为:加成反应;
(3)B的结构简式为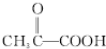 ,B所含官能团的名称为羰基、羧基,故答案为:羰基、羧基;
,B所含官能团的名称为羰基、羧基,故答案为:羰基、羧基;
(4)根据C的结构可知,含两个-COOCH3基团的 C 的同分异构体为CH3OOCC(CH3)2COOCH3、CH3OOCC(CH2CH3)COOCH3、CH3OOCCH2CH2CH2COOCH3、CH3OOCCH2CH(CH3)COOCH3,共4种,其中核磁共振氢谱呈现 2 个吸收峰的异构体结构简式为CH3OOCC(CH3)2COOCH3,
故答案为:4;CH3OOCC(CH3)2COOCH3;
(5)根据上面的分析可知,G为 ,故答案为:
,故答案为: ;
;
(6)E、F的结构简式分别为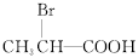 和
和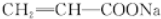 ,E→F 反应的化学方程式为
,E→F 反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机合成的分析和推断,注意把握常见有机物的官能团的性质,注意反应条件,比较反应物和生成物的结构确定反应是解答关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸、浓硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
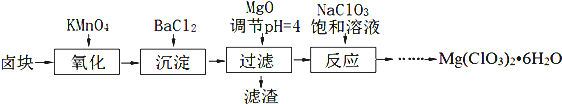
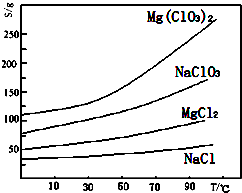
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ①②④ | D. | ①②④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| X | 单质为双原子分子,在空气中所占体积约为78% |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
 ;
; ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
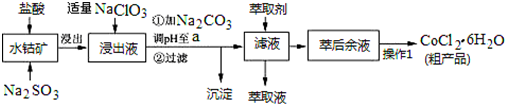
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
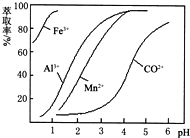
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
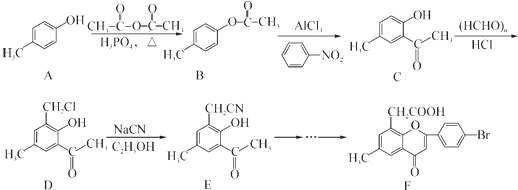
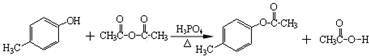 .
.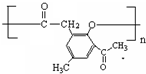 .
.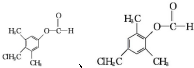 .
.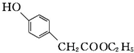 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: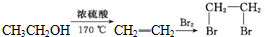
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com