
| ĪĀ ¶Č£Ø”ę£© | 360 | 440 | 520 |
| KÖµ | 0£®036 | 0£®010 | 0£®0038 |
 CO(g) + 3H2(g) »ńČ”£¬ŅŃÖŖøĆ·“Ó¦ÖŠ£¬µ±³õŹ¼»ģŗĻĘųÖŠµÄ
CO(g) + 3H2(g) »ńČ”£¬ŅŃÖŖøĆ·“Ó¦ÖŠ£¬µ±³õŹ¼»ģŗĻĘųÖŠµÄ 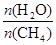 ŗć¶ØŹ±£¬ĪĀ¶Č”¢Ń¹Ēæ¶ŌĘ½ŗā»ģŗĻĘųCH4ŗ¬ĮæµÄÓ°ĻģČēĻĀĶ¼ĖłŹ¾£ŗ
ŗć¶ØŹ±£¬ĪĀ¶Č”¢Ń¹Ēæ¶ŌĘ½ŗā»ģŗĻĘųCH4ŗ¬ĮæµÄÓ°ĻģČēĻĀĶ¼ĖłŹ¾£ŗ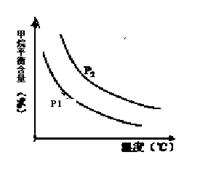
 CO2 (g) + H2(g) »ńČ””£
CO2 (g) + H2(g) »ńČ””£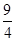 »ņ2£®25 ¢Ś cŗĶd
»ņ2£®25 ¢Ś cŗĶd CO(g) + 3H2(g)£¬ÕżĻņĘųĢåĢå»żŌö“ó£¬Ń¹ĒæŌ½“óCH4ŗ¬ĮæŌ½øߣ¬ĖłŅŌ£¬P1<P2£»¢Śŗć¶ØŃ¹ĒæŹ±£¬ĪĀ¶ČŌ½øߣ¬CH4ŗ¬ĮæŌ½µĶ£¬øĆ·“Ó¦ĪŖĪüČČ·“Ó¦”£
CO(g) + 3H2(g)£¬ÕżĻņĘųĢåĢå»żŌö“ó£¬Ń¹ĒæŌ½“óCH4ŗ¬ĮæŌ½øߣ¬ĖłŅŌ£¬P1<P2£»¢Śŗć¶ØŃ¹ĒæŹ±£¬ĪĀ¶ČŌ½øߣ¬CH4ŗ¬ĮæŌ½µĶ£¬øĆ·“Ó¦ĪŖĪüČČ·“Ó¦”£

 ĶسĒѧµäĬŠ“ÄÜŹÖĻµĮŠ“š°ø
ĶسĒѧµäĬŠ“ÄÜŹÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
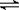 CH3OH(g) ¦¤H£¬ĻĀ±ķĖłĮŠŹż¾ŻŹĒøĆ·“Ó¦ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄ»ÆŃ§Ę½ŗā³£Źż(K)”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
CH3OH(g) ¦¤H£¬ĻĀ±ķĖłĮŠŹż¾ŻŹĒøĆ·“Ó¦ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄ»ÆŃ§Ę½ŗā³£Źż(K)”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ| ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
| K | 2.041 | 0.270 | 0.012 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 ”£“ļµ½Ę½ŗāדĢ¬Ź±£¬Čē¹ūÉżøßĪĀ¶Č(ĘäĖüĢõ¼ž²»±ä)£¬ŌņKÖµ¼õŠ””£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
”£“ļµ½Ę½ŗāדĢ¬Ź±£¬Čē¹ūÉżøßĪĀ¶Č(ĘäĖüĢõ¼ž²»±ä)£¬ŌņKÖµ¼õŠ””£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )A£®·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖNO2(g)+SO2(g)  NO(g)+SO3(g) ¦¤H>0 NO(g)+SO3(g) ¦¤H>0 |
| B£®»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ±£³Ö²»±ä£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā |
| C£®Ņ»¶ØĢõ¼žĻĀ“ļµ½Ę½ŗāŹ±£¬ĖõŠ”ČŻĘ÷Ģå»ż£¬Ōö“óĢåĻµŃ¹Ē棬ĘųĢåŃÕÉ«¼ÓÉī |
| D£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮæÉŹ¹øĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹŗĶĘ½ŗā³£ŹżŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2SO3“ļµ½Ņ»¶ØĻŽ¶ČŗóĶØČė18O2,Ņ»¶ĪŹ±¼ä18OæÉÄÜ“ęŌŚÓŚ£Ø £©
2SO3“ļµ½Ņ»¶ØĻŽ¶ČŗóĶØČė18O2,Ņ»¶ĪŹ±¼ä18OæÉÄÜ“ęŌŚÓŚ£Ø £©| A£®SO3ŗĶO2 ÖŠ | B£®SO3ŗĶSO2 ÖŠ |
| C£®SO3£¬ SO2ŗĶO2 ÖŠ | D£®SO2ŗĶO2 ÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
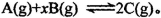 ”£ø÷ČŻĘ÷µÄ·“Ó¦ĪĀ¶Č”¢·“Ó¦ĪļĘšŹ¼Į棬·“Ó¦¹ż³ĢÖŠCµÄÅضČĖꏱ¼ä±ä»Æ¹ŲĻµ·Ö±šČēĻĀĶ¼±ķĖłŹ¾£ŗ
”£ø÷ČŻĘ÷µÄ·“Ó¦ĪĀ¶Č”¢·“Ó¦ĪļĘšŹ¼Į棬·“Ó¦¹ż³ĢÖŠCµÄÅضČĖꏱ¼ä±ä»Æ¹ŲĻµ·Ö±šČēĻĀĶ¼±ķĖłŹ¾£ŗ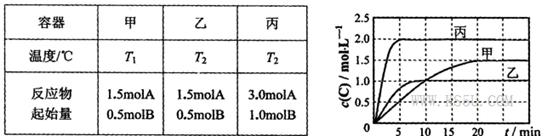
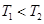 £¬ĒŅøĆ·“Ó¦ĪŖĪüČČ·“Ó¦
£¬ĒŅøĆ·“Ó¦ĪŖĪüČČ·“Ó¦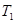 ”ęĻĀ£¬ČōĘšŹ¼Ź±Ļņ¼×ČŻĘ÷ÖŠ³äČė0.5molA”¢1.5molB£¬Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ25%
”ęĻĀ£¬ČōĘšŹ¼Ź±Ļņ¼×ČŻĘ÷ÖŠ³äČė0.5molA”¢1.5molB£¬Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ25%²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(g) ¦¤H=£QkJ/mol”£ÓŠ¼×”¢ŅŅĮ½øöČŻ»żĻąĶ¬ĒŅ²»±äµÄĆܱÕČŻĘ÷£¬Ļņ¼×ČŻĘ÷ÖŠ¼ÓČė1 mol AŗĶ3 mol B£¬ŌŚŅ»¶ØĢõ¼žĻĀ“ļµ½Ę½ŗāŹ±·Å³öČČĮæĪŖQ1kJ£»ŌŚĻąĶ¬µÄĢõ¼žĻĀ£¬ĻņŅŅČŻĘ÷ÖŠ¼ÓČė2 mol C“ļµ½Ę½ŗāŗóĪüŹÕČČĮæĪŖQ2 kJ£»ŅŃÖŖQ1=3Q2”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø £©
2C(g) ¦¤H=£QkJ/mol”£ÓŠ¼×”¢ŅŅĮ½øöČŻ»żĻąĶ¬ĒŅ²»±äµÄĆܱÕČŻĘ÷£¬Ļņ¼×ČŻĘ÷ÖŠ¼ÓČė1 mol AŗĶ3 mol B£¬ŌŚŅ»¶ØĢõ¼žĻĀ“ļµ½Ę½ŗāŹ±·Å³öČČĮæĪŖQ1kJ£»ŌŚĻąĶ¬µÄĢõ¼žĻĀ£¬ĻņŅŅČŻĘ÷ÖŠ¼ÓČė2 mol C“ļµ½Ę½ŗāŗóĪüŹÕČČĮæĪŖQ2 kJ£»ŅŃÖŖQ1=3Q2”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø £© A£Øg£©+3B£Øg£© ¦¤H= £«Q2 kJ/mol
A£Øg£©+3B£Øg£© ¦¤H= £«Q2 kJ/mol²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 XC(g)+D(S)£¬Ļņ¼ŅÖŠĶØČė6molAŗĶ2molB£¬ĻņŅŅÖŠĶØČė1.5molA”¢0.5molB”¢3molCŗĶ2molD£¬·“Ó¦Ņ»¶ĪŹ±¼äŗ󶼓ļµ½Ę½ŗā£¬“ĖŹ±²āµÄ¼×”¢ŅŅĮ½øöČŻĘ÷ÖŠµÄCµÄĢå»ż·ÖŹż¶¼ŹĒ0.2£¬ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ£ŗ
XC(g)+D(S)£¬Ļņ¼ŅÖŠĶØČė6molAŗĶ2molB£¬ĻņŅŅÖŠĶØČė1.5molA”¢0.5molB”¢3molCŗĶ2molD£¬·“Ó¦Ņ»¶ĪŹ±¼äŗ󶼓ļµ½Ę½ŗā£¬“ĖŹ±²āµÄ¼×”¢ŅŅĮ½øöČŻĘ÷ÖŠµÄCµÄĢå»ż·ÖŹż¶¼ŹĒ0.2£¬ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2NH3(g)£»¦¤H£½”Ŗ92.4 kJ/mol”£“ļµ½Ę½ŗāŹ±£¬·Å³öČČĮæ46.2 kJ”£Ēó£ŗ
2NH3(g)£»¦¤H£½”Ŗ92.4 kJ/mol”£“ļµ½Ę½ŗāŹ±£¬·Å³öČČĮæ46.2 kJ”£Ēó£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®æŖĘōĘ”¾ĘĘæŗó£¬ĘæÖŠĮ¢æĢ·ŗĘš“óĮæÅŻÄ |
| B£®ÓÉH2”¢I2ÕōĘų”¢HI×é³ÉµÄĘ½ŗāĢåĻµ¼ÓŃ¹ŗóŃÕÉ«±äÉī |
| C£®ĻņĀČĖ®ÖŠ¼ÓCaCO3ŗó£¬ČÜŅŗĘư׊ŌŌöĒæ |
| D£®Na2CO3ČÜŅŗÖŠ¼Ó·ÓĢŖ£¬ČÜŅŗ±äŗģ£¬¼ÓČČ£¬ŃÕÉ«±äÉī |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com