
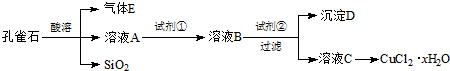
| 离子种类 pH | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀 | 2.7 | 5.4 | 8.1 |
| 沉淀完全 | 3.7 | 6.9 | 9.6 |
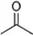
分析 孔雀石用盐酸溶解,主要成份Cu2(OH)2CO3与其反应生成二氧化碳和氯化铜,以及铁的氯化物,其中的二氧化硅是酸性氧化物不溶解,然后加入氧化剂将亚铁转化为易除的铁离子,过滤,将滤液在酸性条件下蒸发结晶,得到氯化铜晶体,
(1)因为要制备氯化铜晶体,为不引入新的杂质,所以加入盐酸;加入氧化剂不能引入新的杂质,所以选用氯气或者过氧化氢;
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围,试剂②可以是氧化铜、氢氧化铜、碳酸铜或者碱式碳酸铜,由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失;
(3)①CuCl2•xH2O晶体加热时会发生水解;
②加热沉淀至质量不再减轻为止,b g为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),再结合m=nM计算x的值.
解答 解:孔雀石用盐酸溶解,主要成份Cu2(OH)2CO3与其反应生成二氧化碳和氯化铜,以及铁的氯化物,其中的二氧化硅是酸性氧化物不溶解,然后加入氧化剂将亚铁转化为易除的铁离子,过滤,将滤液在酸性条件下蒸发结晶,得到氯化铜晶体,
(1)因为要制备氯化铜晶体,为不引入新的杂质,所以加入盐酸;加入氧化剂不能引入新的杂质,所以选用氯气或过氧化氢,故答案为:盐酸;BE;
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4,所以试剂②可以是氧化铜、氢氧化铜、碳酸铜或者碱式碳酸铜,由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等;氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;CuO、Cu(OH)2;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失;
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O?Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大,故答案为:CuCl2•xH2O晶体加热时会发生水解;
②b g为CuO质量为$\frac{bg}{80g/mol}$=$\frac{b}{80}$mol,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以ag=$\frac{b}{80}$mol×(135+18x)g/mol,解得,x=$\frac{80a-135b}{18b}$,
故答案为:$\frac{80a-135b}{18b}$.
点评 考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 电流由锌经外电路流向氧化银 | |
| B. | 锌是负极,氧化银是正极 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据键线式回答下列问题:
根据键线式回答下列问题: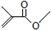 分子式:C5H8O2,
分子式:C5H8O2,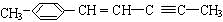 分子中最多有4个原子共直线;
分子中最多有4个原子共直线;
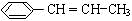 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molAl3+含有的核外电子数为3NA | |
| B. | 将58.5g NaCl溶于1.00 L水中,所得NaCL溶液的浓度为1.00mol•L-1 | |
| C. | 1 molCl2与足量的铁反应,转移的电子为数3Na | |
| D. | 常温下,10LpH=1的硫酸溶液中含有的H+离子数为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以乙烯为原料可以合成聚乙烯等制备生活用品的材料 | |
| B. | 乙烯可以用来制备1,2-二氯乙烷(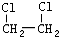 ) ) | |
| C. | 乙烯可以与水发生加成反应制备乙醇(CH3CH2OH) | |
| D. | 乙烯可以与Br2发生加成反应制备二溴乙烷(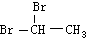 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2 H2O | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | CO2通入过量的澄清石灰水中 CO2+Ca2++2OH-=CaCO3↓+H2O | |
| D. | 钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N2H+5+OH-.
N2H+5+OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com