
【题目】最近科学家合成出了一种由W、X、Y、Z组成的新化合物(如图所示)。W、X、Y、Z为同一短周期元素,W元素焰色为黄色,水体中Y元素含量高会导致水体富营养化,Z的单质常用于给自来水消毒,其核外最外层电子数是X核外电子数的一半。

据此回答下列问题:
(1)X在周期表中的位置为_____。
(2)W、Y、Z形成的简单离子半径从大到小的顺序为_____(用离子符号表示)
(3)Y所在主族的元素形成的最简单氢化物,沸点最低的为_____(填化学式),YZ3中所含化学键为_____ (填“离子键”或“共价键”)
(4)写出证明非金属性Z大于X的判据_____ (任写一条)
(5)实验室中制备Z的单质的离子反应方程式为_____。
【答案】第三周期 Ⅳ A族 P3﹣>Cl﹣>Na+ PH3 共价键 简单氢化物稳定性:HCl>SiH4(或最高价氧化物对应水化物的酸性:HClO4>H2SiO3) MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】
根据元素性质及核外电子排布情况分析元素的种类;根据元素周期表的结构及元素周期律分析解答;根据氯气的实验室制备原理分析解答。
W、X、Y、Z为同一短周期元素,W元素焰色为黄色,则W为钠;水体中Y元素含量高会导致水体富营养化,则Y为氮或磷元素,Z的单质常用于给自来水消毒,则Z为氯;氯最外层电子水为7,是X核外电子数的一半,则X核外电子数为14,X为硅,则Y为磷。
(1)Si的原子序数为14,位于元素周期表中第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,则离子半径:P3->Cl->Na+,故答案为:P3->Cl->Na+;
(3)P位于ⅤA,由于氨气分子间存在氢键,其沸点较高;其它氢化物属于分子晶体,相对分子质量越大沸点越高,属于ⅤA族元素形成的氢化物中沸点最低为PH3; PCl3属于共价化合物,其分子中只存在共价键,故答案为:PH3;共价键;
(4)简单氢化物稳定性:HCl>SiH4(或最高价氧化物对应水化物的酸性:HClO4>H2SiO3),证明非金属性:Cl>Si,故答案为:简单氢化物稳定性:HCl>SiH4(或最高价氧化物对应水化物的酸性:HClO4>H2SiO3);
(5)实验室中加热浓盐酸与二氧化锰制备氯气,发生反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
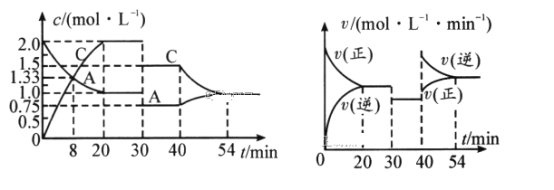
(1)0~20min,A的平均反应速率为__mol/(L·min);8min时,v正__v逆(填“>”“=”或“<”)。
(2)反应方程式中的x=__,30min时改变的反应条件是__。
(3)20~30min时反应的平衡常数__(填“>”“=”或“<”)3040min时反应的平衡常数。
(4)该反应的正反应为__(填“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是_min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。已知:25℃H2S电离常数分别为Ka1=1.3×10—7,Ka2=7.0×10—15,某溶液含0.02mol/LMn2+、0.1mol/LH2S,向该溶液中通入HCl气体或加入NaOH固体以调节溶液pH,(忽略溶液体积的变化、H2S的挥发)。当溶液的pH=5时,Mn2+开始沉淀为MnS,则:
(1)HS—的电离常数表达式为______________;
(2)Na2S溶液中的微粒有_____________种;
(3)NaHS溶液的pH_____________7(填“>”、“=”或“<”),理由是__________________;
(4)当溶液的pH=5时,c(S2—)∶c(H2S)=______________;
(5)MnS的溶度积为_____________;
(6)当Mn2+完全沉淀时,溶液中c(S2—)=____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O (莫尔盐,浅绿色)是重要的化工原料和化学试剂。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
(1)甲组同学猜想:莫尔盐的分解产物可能是N2、Fe2O3、SO3和H2O四种物质。你是否同意甲组同学的猜想,并说明理由:______________________。
(2)乙组同学按照如下图所示的装置进行实验,关闭止水夹,加热A中的莫尔盐固体至分解完全,检验其分解产物。
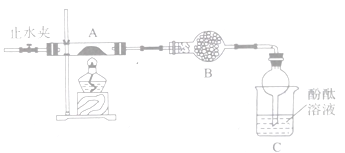
①装置B的仪器名称是______________,所盛试剂是_________________。
②装置C中可观察到的现象是________________, 由此可知硫酸亚铁铵分解的产物中有___________。
(3)丙组同学选用乙组实验中的装置A和下图所示的装置,进行实验验证莫尔盐分解的产物中还有SO2和SO3。
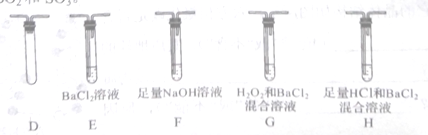
①丙组同学的实验装置中,依次连接的合理顺序为A______________(用装置字母表示)。取适量固体于A中,通入 N2一段时间后,关闭止水夹,冉点燃酒精灯。通入N2的目的是___________________ 。
②若装置H中有白色沉淀生成,则证明分解产物中有__________________;能证明分解产物中有SO2的实验现象是___________________ 。
(4)丁组同学将一定量的莫尔盐在500℃的隔绝空气加热—段时间后,检验其固体产物。设计实验证明,此固体产物不含二价铁:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A. 0.1 mol L1的盐酸15 mL B. 0.2 mol L1的盐酸12 mL
C. 0.15 mol L1的硫酸溶液8 mL D. 18 mol L1的浓硫酸15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
请回答下列问题。
(1)H2O的摩尔质量为___________,0.18g H2O的物质的量为_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,则需要H2SO4的质量为_____________g
(3)在上述的反应中,若生成22g CO2
ⅰ.标准状况下,CO2的体积为_________L
ⅱ.转移电子的数目为________________
(4)标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,则该混合气体的平均相对分子质量是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常检测 SO2 含量是否达到排放标准的反应原理是 SO2 +H2O2 + BaCl2 =BaSO4↓+ 2HCl,NA 表示阿伏伽德罗常数,下列说法正确的是()
A.上述反应生成 2.33 g BaSO4 沉淀时,转移电子数目为 0.01NA
B.17 g H2O2 中含有非极性键数目为 0.5NA
C.0.1 mol BaCl2 晶体中所含微粒总数为 0.3NA
D.25 ℃时,pH =1 的 HCl 溶液中含有 H+的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香化合物 A 和 E 为原料合成枸橼酸托瑞米芬的中间体 I 的一种合成路线如图所示:

已知:①CH3CHO+CH3CHO ![]() CH3CH(OH)CH2CHO;②CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO;②CH3CH(OH)CH2CHO ![]() CH3CH=CHCHO+H2O。
CH3CH=CHCHO+H2O。
回答下列问题:
(1)A 的化学名称是__________,I 中含氧官能团的名称是_______________。
(2)A 生成 B 的反应类型是__________。
(3)D 的结构简式为__________。
(4)E 生成 F 的化学方程式为__________。
(5)芳香化合物X 是G 的同分异构体,X 分子中除苯环外不含其他环状结构,且苯环上只有3 个取代基,X能与 NaHCO3 反应生成 CO2,其核磁共振氢谱有 4 组峰,峰面积之比为 6∶2∶1∶1。符合上述要求的X 的结构简式为__________(写一种)。
(6)写出由氯乙烷和甲醛为原料制备化合物 C(CH2OH)4 的合成路线__________。(无机试剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,转化关系如下如所示:下列说法不正确的是( )

A. x为NaOH溶液,y为盐酸
B. a→b发生的反应为:AlO2-+H++H2O=Al(OH)3↓
C. 按照本流程,x和y调换后也能达到实验目的
D. b、c既能与强酸又能与强碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com