
(16分)已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
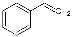
反应②: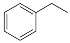 (g)
(g)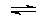
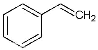 (g)+H2(g),ΔH= +117.6 kJ/mol。
(g)+H2(g),ΔH= +117.6 kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
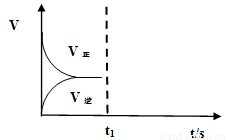
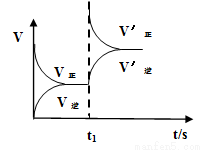
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125 mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂
(1)CO2(g)+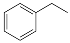 (g)
(g) 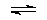
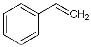 (g)+CO(g)+H2O(g),ΔH=+158.8 kJ/mol(3分);
(g)+CO(g)+H2O(g),ΔH=+158.8 kJ/mol(3分);
K= K1·K2(2分)
(2)(3分,曲线趋势正确2分,标示正确1分)
(3)0.5或 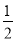 (2分);50% (2分)
(2分);50% (2分)
(4)①吸热 (2分) ②B C (2分)
【解析】
试题分析:(1)已知反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH= +41.2 kJ/mol;反应②:
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;反应②: (g)
(g)
 (g)+H2(g),ΔH= +117.6 kJ/mol;根据盖斯定律:①+②,得 CO2(g)+
(g)+H2(g),ΔH= +117.6 kJ/mol;根据盖斯定律:①+②,得 CO2(g)+ (g)
(g) 
 (g)+CO(g)+H2O(g),ΔH=+158.8 kJ/mol;反应①与反应②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1?K2;
(g)+CO(g)+H2O(g),ΔH=+158.8 kJ/mol;反应①与反应②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1?K2;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为
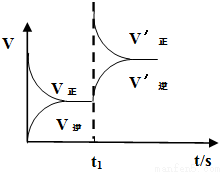 ;
;
(3)平衡时c(NO2)=0.50mol/L、c(N2O4)=0.125 mol/L,则可逆反应2NO2(g) N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K= 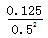 =0.5;根据方程式可知
=0.5;根据方程式可知
2NO2(g) N2O4(g)
N2O4(g)
起始浓度(mol/L) 2 0
转化浓度(mol/L) x 0.5x
平衡浓度(mol) 2-x 0.5x
则根据平衡常数可知 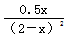 =0.5
=0.5
解得x=1或4,其中x=x舍去
因此NO2的转化率是50%
(4)①根据表中数据可知,随着温度的升高平衡常数逐渐增大。说明升高温度平衡向正反应方向进行,因此正方应是吸热反应。
②A.及时分离出CO气体,平衡向正反应方向进行,但反应速率降低,A错误;B.适当升高温度,反应速率增大,平衡向正反应方向进行,B正确;C.增大CO2的浓度反应速率增大,平衡向正反应方向进行,C正确;D.选择高效催化剂,反应速率增大,但平衡不移动,D错误,答案选BC。
考点:考查盖斯定律的应用、平衡常数计算、外界条件对反应速率和平衡状态的影响


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、神舟10号飞船所用太阳能电池板的材料是单晶硅 | B、用于制作集成电路板的酚醛树脂是天然高分子化合物 | C、工业上获得大量乙烯、丙烯、丁二烯的方法是石油裂化 | D、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:填空题
(16分)已知合成氨的反应为3H2(g)+N2(g) 2NH3(g) △H<0,在某密闭容器中测得实验数据及数据处理如下表。
2NH3(g) △H<0,在某密闭容器中测得实验数据及数据处理如下表。
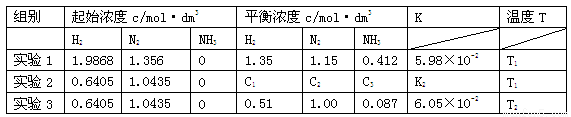
(1)下列说法可以说明合成氨反应达到平衡的是
A.恒容时,整个容器内密度不变
B.恒压时,容器内平均相对分子质量不变
C.1 mol N≡N键断裂的同时,有3mol H-H键断裂
(2)当升高温度时,平衡向 方向移动(填“正”或“逆”),请画出在t2时刻升温后的v-t图,并作出必要的标注。

(3)表中实验2的K2= ,温度T1、T2的大小关系是 ,你判断的理由是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是(N-14 O-16 C-12 H-1)
A.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
B.标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NA
C.16g CH4与18 g NH4+ 所含质子数相等
D.1molCu在足量硫蒸气中反应时转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2能使溴水褪色 |
B | 铁比铜活泼 | 铜容器可以盛放浓硝酸 |
C | 铜绿的主成分是碱式碳酸铜 | 可用稀盐酸除去铜器表面的铜绿 |
D | 铜表面易形成致密的氧化膜 | 铜板上的铁钉在潮湿空气中不易生锈 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质 | CH4 | CO2 | CO | H2 |
平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
① 温度与催化剂的催化效率和乙酸的生成速率如图。

250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 稀盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:填空题
(11分)以食盐为原料进行生产并综合利用的某些过程如下图所示。
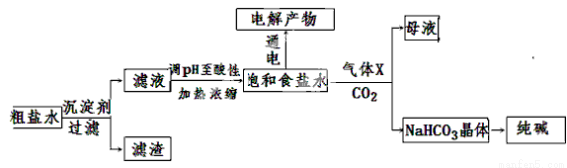
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com