
【题目】(1)1mol HNO3的质量是____________, 1mol HNO3含有_____mol氧原子。
(2)标准状况下11.2L HCl气体溶于水中配成1L溶液,所得盐酸溶液的物质的量浓度是_______________。
(3)2mol OH 约含有__________________个电子。
(4)9.5gMgCl2固体溶于水配成500mL溶液,其中Cl-浓度为________mol· L-1。
【答案】 63g 3 0.5 mol·L-1 1.204×1025 0.4
【解析】试题分析:本题考查以物质的量为中心的计算,物质的量浓度的计算。
(1)M(HNO3)=63g/mol,1molHNO3的质量为1mol![]() 63g/mol=63g。1molHNO3含有3mol氧原子。
63g/mol=63g。1molHNO3含有3mol氧原子。
(2)n(HCl)=![]() =0.5mol,c(HCl)=
=0.5mol,c(HCl)=![]() =0.5mol/L。
=0.5mol/L。
(3)1个OH-中含有10个电子,2molOH-中含有20mol电子,电子的个数为20mol![]() 6.02
6.02![]() 1023mol-1=1.204
1023mol-1=1.204![]() 1025。
1025。
(4)n(MgCl2)=![]() =0.1mol,c(MgCl2)=0.1mol
=0.1mol,c(MgCl2)=0.1mol![]() 0.5L=0.2mol/L,则c(Cl-)=0.4mol/L。
0.5L=0.2mol/L,则c(Cl-)=0.4mol/L。


科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
I.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:1、4:1时,NO脱除率随温度变化的曲线如图所示。

①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为___________________mg/(m3.s)。
②曲线b对应的NH3与NO的物质的量之比是_______,其理由是___________________。
(2)已知在25℃,101 kPa时:

请写出用NH3脱除NO的热化学方程式:_______________________________。
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:

含硫各微粒(H2SO3、HSO3-和SO32-)存在于装置I反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。

①溶液的pH=8时,溶液中各离子浓度由大到小的顺序是_________________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:___________________________。
(4)装置Ⅱ中NO转变为NO3-的反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g) ![]() 2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝合金与硝酸恰好完全反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36 L O2混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2 mol/L NaOH溶液至沉淀最多时停止加入,将沉淀滤出,向滤液中加水稀释至500 mL,此时所得溶液的物质的量浓度为( )
A. 0.5 mol/L B. 1 mol/L
C. 1.2 mol/L D. 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
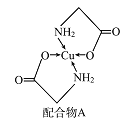
(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
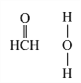
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
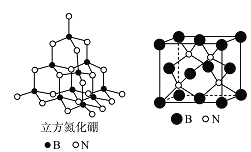
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摩尔庄园”是一款专门为7—12岁儿童(也就是说并不适合很大年齡的你们)安全健康益智网页游戏,它和我们化学高大上的摩尔没有半毛钱的关系,你们总是学不会的“摩尔”其实是指( )
A. 国际单位制中的一个物理量 B. 摩尔是表示物质的量
C. 摩尔是物质的量的单位 D. 摩尔是表示物质数量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的说法不正确的是
A. 高纯硅具有良好的半导体性能,可制成硅芯片、光电池、光导纤维等
B. 二氧化硅能与氢氟酸反应,可用氢氟酸刻蚀玻璃
C. 向硅酸钠溶液中滴加稀盐酸有不溶物生成,实验室可用该方法制备硅酸
D. “硅胶”由硅酸凝胶经干燥、脱水制得,常用作食品、药品等的干燥剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com