
����Ŀ�����������䡱�������������ص㹤�̣������������ָ��Ȼ��������Ҫ�ɷ��Ǽ��飮��ҵ�Ͻ�̼��ˮ�ڸ����·�Ӧ�Ƶ�ˮú����ˮú������Ҫ�ɷ���CO��H2 �� ���ߵ������ԼΪ1��1����֪1mol CO������ȫȼ������CO2����ų�283kJ������1molH2��ȫȼ������Һ̬ˮ�ų�286kJ������1molCH4 ������ȫȼ������CO2�����Һ̬ˮ�ų�890kJ������
��1��д��H2��ȫȼ������Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ�� �� ��1molCH4������ȫȼ������CO2�����ˮ�������ų������� 890kJ�����������=��������
��2������ˮú���������ɷ֣���ͬ״�������õ���ȵ�����������ˮú�������������ԼΪ��ȼ�����ɵ�CO2 ��������ԼΪ ��
��3���������ݺͼ���˵��������Ȼ������ˮú��������ȼ�ϣ�ͻ�����ŵ��� ��
���𰸡�
��1��2H2��g��+O2��g��=2H2O��l����H=��572kJ?mol��1����
��2��3.1��1��1.55��1
��3����ֵ�ߣ���ȾС
���������⣺��1��1mol H2��ȫȼ������Һ̬ˮ�ų�286kJ����������H2��ȫȼ��������̬ˮ���Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��l����H=��572kJmol��1��1mol CH4������ȫȼ������CO2�����Һ̬ˮ�ų�890kJ������Һ̬ˮ��Ϊ��̬ˮ���ȣ�������ͬ�����£�1mol CH4������ȫȼ������CO2�����ˮ�������ų�������С��890kJ��
���Դ��ǣ�2H2��g��+O2��g��=2H2O��l����H=��572kJmol��1��������2�������Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��l����H=��572kJmol��1��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��890kJ/mol��2CO��g��+O2��g��=2CO2��g����H=��566KJ/mol��ˮú������Ҫ�ɷ���CO��H2 �� ���ߵ������Ϊ1��1��1molCH4ȼ�շ���890kJ��1molCO��H2���������� ![]() kJ=284.5kJ����ͬ״�������õ���ȵ�����������ˮú�������������ԼΪ
kJ=284.5kJ����ͬ״�������õ���ȵ�����������ˮú�������������ԼΪ ![]() ��
�� ![]() =3.1��1��ȼ�����ɵ�CO2��������ԼΪ
=3.1��1��ȼ�����ɵ�CO2��������ԼΪ ![]() =1.55��1��
=1.55��1��
���Դ��ǣ�3.1��1��1.55��1����3���������ݺͼ���˵������ͬ���ʵ�������Ȼ����ˮú������Ȼ��ȼ�շų��������࣬����ֵ�ߣ�ȼ�ղ�������������CO2�٣����Դ��ǣ���ֵ�ߣ���ȾС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧϰС���ͬѧ��ͨ����ͼʵ��װ��̽��SO2��Na2O2��Ӧ�IJ�����г�װ������ȥ��װ�õ����������ã�
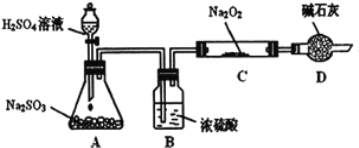
��ʵ����װ��B������ˮ�֣�����SO2���壬��Ŀ���ǣ�________________��װ��D�������չ�����SO2��������Ⱦ�����⣬���������ǣ�_______��
��C�й������������¼��裺������Na2O2��ȫ����Ӧ��
����1��__________��
����2��ֻ��Na2SO4�� ����3������Na2SO3����Na2SO4��
��1����ͬѧ��ΪSO2��Na2O2�ķ�Ӧ��ͬ��CO2��ӦΪ����2��������ݴ�д��C����������Ӧ�Ļ�ѧ����ʽ��_____________________��
��2��������2������Ϊȷ��C�й������ijɷ֣���ͬѧ�������ʵ�飺
![]()
�ó����ۣ�C�й������ֻ��Na2SO4���÷����Ƿ��������__________������ǡ���������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�������壬ȡX��Y��1��1�����ʵ���֮�Ȼ�ϣ������ܱ������з������·�Ӧ��X+2Y2Z���ﵽƽ���û�������з�Ӧ��������ʵ�����������������ʵ���֮��Ϊ3��2����Y��ת������ӽ��ڣ� ��
A.33%
B.40%
C.50%
D.65%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �ⶨ�����ʵ���Ũ�ȵ�Na2CO3��Na2SO4��Һ��pH��ǰ�ߵ�PH�Ⱥ��ߵĴ� | Ԫ�طǽ�������S>C |
B | ��ʢ��Fe(NO3)2��Һ���Թ��м���0.lmol.L-1H2SO4��Һ���Թܿڳ��ֺ���ɫ���� | ��Һ��NO3-��Fe2+��ԭΪNO2 |
C | ��FeBr2��Һ�м���������ˮ���ټ�CCl4��ȡ��CCl4����ɫ | Fe2+�Ļ�ԭ��ǿ��Br- |
D | ����Һ�еμ������ữ��BaC12��Һ��������ɫ���� | ��Һ��һ������SO42- |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)1mol NH4+����Ϊ_____�����к����ӡ����ӵ���Ŀ�ֱ�Ϊ_____��_____��
(2)��״̬�£�672mLij��������Ϊ0.84g��������Ħ������Ϊ_____��
CO ��CO2 ���������ܶ��������Ϊ19����CO ��CO2�����Ϊ_________����ijԭ�ӵ�Ħ��������M g /mol����һ����ԭ�ӵ���ʵ������____________g������״���µ�aLHCl(g)����1000gˮ�У��õ��������ܶ�Ϊbg/mL�������������ʵ���Ũ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����(MnCO3) ������ĸ�����ǿ���Բ��ϣ�Ҳ���Ʊ�Mn2O3��MnO2���̵����������Ҫԭ�ϣ��㷺���ڵ��ӡ�������ҽҩ����ҵ��
(1) ��ҵ���Ʊ�����ʽΪ��MnSO4+2NH4HCO3=MnCO3 ��+ (NH4)2SO4+CO2 ��+H2O����Ӧ��ͨ��������Թ�����NH4HCO3���ҿ�����Һ��pHΪ6.8~7.4�������Թ�����NH4HCO3��Ŀ����_____��
(2) ʵ����ģ�ҵ���������Ʊ�������װ����ͼ4��ʾ��

��ʯ�����������________��
����Ӧ�����У�ΪʹSO2������ת����ȫ����ͨ��SO2��N2����һ�������ı��ҺͶ�ϵ������£��ɲ�ȡ�ĺ�����ʩ��________��
(3) MnCO3 �ڿ����м�����ת��Ϊ��ͬ��̬���̵���������������������¶ȵı仯��ͼ5 ��A��B��C��D ����ʾ����300��ʱ��ʣ���������Ԫ������Ԫ�ص����ʵ���֮�ȼ�n(Mn) :n(O)Ϊ_______�� ͼ�е�D ��Ӧ����ijɷ�Ϊ______ (�ѧʽ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ���Ũ������������̷�Ӧ����ȡ��������������Ӧ�Ļ�ѧ����ʽΪMnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O��
MnCl2��Cl2����2H2O��
��1��д���÷�Ӧ�����ӷ���ʽ__________________________________________
��2���ڷ�Ӧ��MnO2����________(���������ԭ��)��Ӧ����������Ϊ__________
��3����0.1 mol MnO2�μӷ�Ӧʱ��ת�Ƶ�����Ϊ____����������HClΪ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����������ʵ���������������ɵ��ǣ� ��
A.H2O �� O2B.CuO��Cu
C.H2SO4��CuSO4D.Fe��FeCl2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com