
【题目】合成氨工业的核心反应是N2(g)+3H2(g) ![]() 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
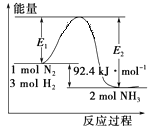
(1)该反应的ΔH=_______kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1 _____(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量_________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol 4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol,则该温度下白磷转化为红磷的热化学方程式:________________________________________________________。
【答案】-92.4 减小 < D P4(s,白磷)= 4P(s,红磷) ΔH=-29.2kJ/mol
【解析】
(1)从图中采集数据,可得出该反应的ΔH。
(2)催化剂可降低反应的活化能,使反应速率增大。
(3)合成氨反应为可逆反应,反应物不可能全部转化为生成物,由此可求出向一密闭容器中充入0.5mol N2和1.5mol H2,放出的热量。
(4)该反应为放热的、体积缩小的可逆反应,由此可确定ΔH<0,ΔS<0。
(5)P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol ①
4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol ②
利用盖斯定律,将①-②,即得该温度下白磷转化为红磷的热化学方程式。
(1)从图中采集数据,可得出该反应的ΔH= -92.4kJ/mol。答案为:-92.4;
(2)催化剂可降低反应的活化能,使反应速率增大,E1减小。答案为:减小;
(3)合成氨反应为可逆反应,反应物不可能全部转化为生成物,则0.5mol N2和1.5mol H2放出的热量<46.2 kJ。答案为:<;
(4)该反应为放热的、体积缩小的可逆反应,由此可确定ΔH<0,ΔS<0,故选D。答案为:D;
(5)P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol ①
4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2=-2954kJ/mol ②
利用盖斯定律,将①-②,即得该温度下白磷转化为红磷的热化学方程式P4(s,白磷)= 4P(s,红磷) ΔH=-29.2kJ/mol。答案为:P4(s,白磷)= 4P(s,红磷) ΔH=-29.2kJ/mol。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵是分析化学中重要的试剂,某实验小组制备和探究其分解产物的实验如下:I.制备硫酸亚铁铵
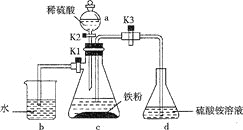
(1)仪器a的名称是__。
(2)将过量铁粉置于c中,加蒸馏水于b中,硫酸铵溶液于d中,按图连接好装置,打开K1、K2,关闭K3.使用铁粉“过量”的原因是___。
(3)关闭K1和K2,打开K3,c中浅绿色溶液流入d,其原因是___;d中析出沉淀,用化学方程式解释:___。
Ⅱ.探究硫酸亚铁铵的部分分解产物
假设气体产物仅有NH3、SO2、SO3(g)和H2O(g),设计如下所需装置进行实验;
已知:CaCl2+8NH3=CaCl2·8NH3
A.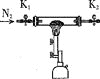 B.
B. C.
C.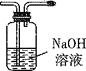 D.
D.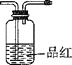 E.
E.![]()
①将I中制备的沉淀装入A,装置连接顺序为___,打开K1和K2,缓缓通入N2,一段时间后,关闭K1开始加热,实验后反应管中残留固体为红色粉末;
②B、D中有气泡冒出,还可观察到的现象分别为__,
③硫酸亚铁铵的分解方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等; ②单位时间内amol A生成,同时生成3amol B;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的物质的量不再变化; ⑥单位时间消耗amol A,同时生成3amol B;⑦A 、B、C的分子数目比为1:3:2。
A.②⑤B.①③C.②⑦D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)0.005mol/L的H2SO4溶液的pH为_______。
(2)常温时,0.1mol/L的NaOH和0.06mol/L的H2SO4溶液等体积混合,求混合溶液的pH为_______。
(3)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________,该温度________(填“高于”或“低于”)25 ℃。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。若所得混合溶液呈中性,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为 C8H8O2。A的核磁共振氢谱有4个峰且面积之比为 1∶2∶2∶3,A 分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于 A 的下列说法中,不正确的是( )
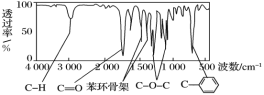
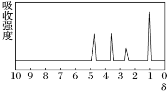
A.A属于芳香烃B.A的结构简式为![]()
C.A属于羧酸类化合物D.在红外光谱图中可以获得分子中含有的化学键或官能团的信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。如下图所示装置是用燃烧法确定有机物化学式常用的装置,这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
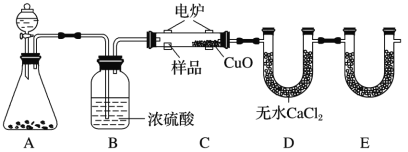
回答下列问题:
(1)A装置分液漏斗中盛放的物质是_______,写出有关反应的化学方程式:________。
(2)C装置(燃烧管)中CuO的作用是__________。
(3)写出E装置中所盛放试剂的名称:________,它的作用是__________。
(4)若将B装置去掉会对实验造成什么影响?________。
(5)若准确称取 18.0g样品(只含 C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加26.4g,D 管质量增加 10.8g,则该有机物的最简式为__________。
(6)要确定该有机物的分子式,还需要测定______,目前最精确、最快捷的测定方法是________。称取A物质18.0g,升温使其汽化,测其密 度是相同条件下H2的45倍。试通过计算填空:A的相对分子质量为______。
(7)另取A18.0g与足量的NaHCO3粉末反应,生成0.2mol CO2,若与足量钠反应则生成 0.2molH2。若核磁共振氢谱如下图,则该分子可能为__________(填结构简式),其中所含官能团的名称______。确定该有机物的物理方法是_______。
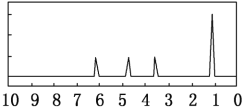
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,恒温条件下,向某一体积为2L的密闭容器中充入2molN2和6molH2,经10s达到平衡,平衡后压强为初始压强的
2NH3(g) △H<0,恒温条件下,向某一体积为2L的密闭容器中充入2molN2和6molH2,经10s达到平衡,平衡后压强为初始压强的![]() 。则下列说法正确的( )
。则下列说法正确的( )
A.要提高N2转化率同时加快反应速率,可采取的措施有缩小体积、充入N2、降低温度
B.若该反应的平衡常数发生变化,平衡不一定移动
C.保持温度和容器体积不变,再向容器中充入1molN2和2molNH3,此时v正=v逆
D.10s内,v(NH3)=0.1mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com