
【题目】现有下列4种物质:① NH3 ②浓硝酸 ③ 浓硫酸 ④ NO。其中,遇空气迅速变成红棕色的气体是____(填序号,下同),能使湿润的红色石蕊试纸变蓝的气体是____,加入蔗糖产生“黑面包”现象的溶液是____,常温下,能用铁制容器盛放的溶液是____。
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟元素为非金属性最强的元素,氟无正价
B.第ⅠA、ⅡA族元素都具有较强的金属性
C.非金属性:F>Cl>Br>I,则酸性HF>HCl>HBr>HI
D.碱性:NaOH<Mg(OH)2<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,在工业上可用于制造化肥、农药、炸药和染料等。下列关于浓硝酸性质的描述不正确的是
A.难挥发B.能溶于水C.能与碳反应D.能与氨气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 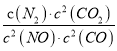 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
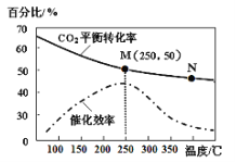
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
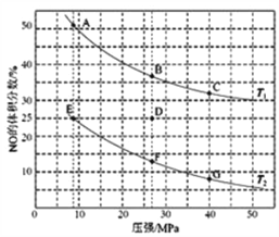
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工原料,广泛应用于有机合成、石油、油脂、染料等工业。一种利用低品位铜矿(Cu2S、CuS及FeO和Fe2O3等)为原料制取CuCl的工艺流程如下:
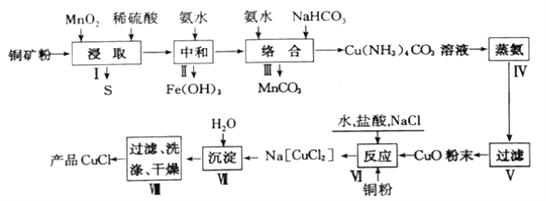
回答下列问题:
(1)步骤Ⅰ“浸取”前需将铜矿粉碎的目的是______;“浸取”时,被氧化的元素有___(填元素符号)。
(2)已知Cu2+、Mn2+、Fe3+开始生成沉淀和沉淀完全的pH如下表,则步骤Ⅱ“中和”时,pH应控制的范围为_______________;
物质 | Cu(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 8.3 | 1.2 |
完全沉淀pH | 6.7 | 9.8 | 3.2 |
已知25℃时Ksp(MnCO3)=2.4×10—11、离子浓度为1.0×10-5mol/L时即完全沉淀,步骤Ⅲ中Mn2+完全沉淀时c(CO32—)= ________________。
(3)步骤IV加热“蒸氨”时发生反应的化学方程式为________________。
(4)步骤VI反应的离子方程式为______________,其中盐酸需过量,其原因是________________。
(5)步骤Ⅶ获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常有无水乙醇代替蒸馏水做洗涤剂的优点是______________(写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )
A.甲烷B.新戊烷C.乙烯D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。
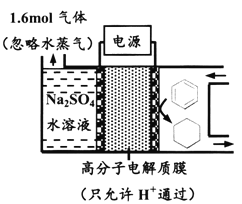
已知储氢装置的电流效率![]() 100%,下列说法不正确的是
100%,下列说法不正确的是
A. 若η=75%,则参加反应的苯为0.8mol
B. 过程中通过C—H键断裂实现氢的储存
C. 采用多孔电极增大了接触面积,可降低电池能量损失
D. 生成目标产物的电极反应式为:C6H6+6e-+6H+=C6H12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com