
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) mol/L | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| c(NO2) mol/L | 0.000 | 0.060 | 0.100 | 0.120 | 0.120 | 0.120 |
分析 ①60s、80s、100s时二氧化氮与四氧化二氮的浓均不变,说明均处于平衡状态;当其他条件不变,时间为120秒时属于平衡状态;
②根据v=$\frac{△c}{△t}$计算υ(N2O4 );
③对此平衡体系降低温度后,气体的颜色变浅,说明二氧化氮浓度减小,平衡向逆反应移动;
④若在此反应中加入适宜的催化剂影响化学反应速率,不影响平衡移动.
解答 解:①60s、80s、100s时二氧化氮与四氧化二氮的浓均不变,说明均处于平衡状态;当其他条件不变,时间为120秒时属于平衡状态,c(NO2)=0.120mol/L,
故答案为:60s、80s、100s;0.120;
②反应开始至60秒时,平均速率υ(N2O4 )=$\frac{(0.1-0.04)mol/L}{60s}$=0.001mol/(L•s),
故答案为:0.001;
③对此平衡体系降低温度后,气体的颜色变浅,说明二氧化氮浓度减小,平衡向逆反应移动,则正反应为吸热反应,
故答案为:吸热;
④若在此反应中加入适宜的催化剂影响化学反应速率,不影响平衡移动,
故答案为:影响;不影响.
点评 本题考查化学平衡及其影响因素、反应速率计算等,比较基础,注意对基础知识的理解掌握.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液和硫化钠溶液反应制备Al2S3 | |
| B. | 用镁粉和空气反应制备Mg3N2 | |
| C. | 用铝粉和MnO2制得锰 | |
| D. | 电解熔融氯化铝的方法制得单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | 无 |
| ② | 取少量滤液于试管中, 滴入稀HNO3和AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,测定熔点 | 白色晶体在122.4℃左右完全熔化 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 仰视量筒刻度量取一定量浓硫酸所配制的0.10 mol•L-1 H2SO4溶液的浓度结果偏低 | |
| C. | 焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色 | |
| D. | 要将溶解在CCl4中的碘分离出来,以用蒸馏法,因为碘易升华,先分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
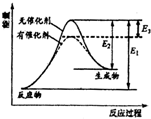 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )| A. | 该反应为放热反应 | B. | 该反应的焓变△H=E3 | ||
| C. | 催化剂不能降低反应的活化能 | D. | 该反应逆反应的焓变△H=E2-E1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com