
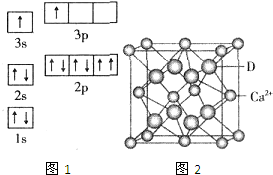
 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| m |
| ρ |
| 1 |
| 8 |
| 1 |
| 2 |
| 78 |
| NA |
| ||
| ag/cm3 |
| 4×78 |
| aNA |
| 4×78 |
| aNA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 灼烧 |
| 浸泡 |
| ① |
| ② |
| 适量Cl2 |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 |
| B、除去乙醇中少量乙酸:加入碳酸钠溶液,分液 |
| C、除去FeCl3溶液中少量的CuCl2:加入过量铁粉,过滤 |
| D、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未洗涤烧杯和玻璃棒 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
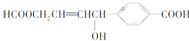
| A、1 mol该有机物可以与3 mol Na发生反应 |
| B、1 mol该有机物可以与3 mol NaOH发生反应 |
| C、1 mol该有机物可以与6 mol H2发生加成反应 |
| D、1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com