
科目:高中化学 来源: 题型:
| 4 |
| 17 |
| 实验序号 | 实验过程 | 实验现象和数据 |
| 1 | 准确称取13.6g X在足量O2中充分燃烧,并使其产物依次通过浓硫酸、无水硫酸铜粉末、足量石灰水,并检测尾气 | 浓硫酸增加7.2g,硫酸铜粉末没有变蓝,石灰水中有80.0g白色沉淀生成,检测最后的气体只有氧气 |
| 2 | 用一试管取少量X,向其中滴入几滴FeCl3溶液,震荡 | 溶液由无色变紫色 |
| 3 | 将几滴X滴入新配置的银氨溶液中,并水浴加热 | 有银镜产生 |
| 4 | 核磁共振氢谱法测定其氢原子种类 | 分子中有5种氢原子 |


 +2Ag(NH3)2OH
+2Ag(NH3)2OH| 水浴 |
 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O +2Ag(NH3)2OH
+2Ag(NH3)2OH| 水浴 |
 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学反应2A(g)B (g)+D(g)在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示.
某化学反应2A(g)B (g)+D(g)在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示.实验序号 |
时间 浓度 温度/℃ |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| 4 | 760 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X-射线衍射法是通过X-射线衍射仪测出离子化合物中离子间的间隔,进而测出阿伏加德罗常数的值。已知: X-射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的间距为2.819×10-8cm。相对原子质量为:Na:22.99,Cl:35.45。NaCl晶体模型如右图所示。
X-射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的间距为2.819×10-8cm。相对原子质量为:Na:22.99,Cl:35.45。NaCl晶体模型如右图所示。
为了测定阿伏加德罗常数,某同学做了下列实验:用分析天平称取研细的一定质量的NaCl固体,装入25mL容量瓶中,然后用滴定管向容量瓶中滴加苯,并不断振荡,使苯和NaCl晶体充分混合,加至刻度。其实验数据记录于下表:
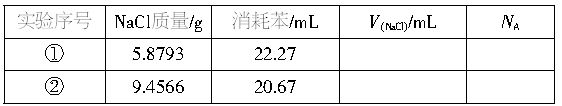
请根据实验数据填写出两次实验中未完成的空格(阿伏加德罗常数NA项只要求写出计算表达式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省襄阳市高三12月统一测试理综化学试卷(解析版) 题型:填空题
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:
 2SO2(g)+O2(g)
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
2SO2(g)+O2(g)
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
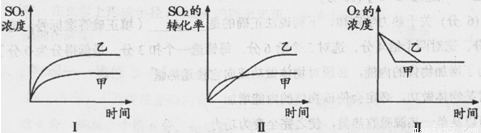
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
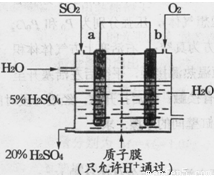
(4)某实验小组设想如下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
SO2(g)+O2(g) 2SO3(g) △H1=-197 kJ/mol;
2SO3(g) △H1=-197 kJ/mol;
H2O(g)=H2O(1) △H2=-44 kJ/mol:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(1) H3=-545 kJ/mol。
写出SO3(g)与H2O(1)反应的热化学方程式是 。
(6)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比 。[已知该温度时,Ksp(BaSO4)=1.3x10-10,KsP(BaCO3)=5.2x10-9]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com