
| A、0.15mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |


科目:高中化学 来源: 题型:
| A、熄灭酒精灯时,用嘴吹灭 |
| B、称量药品时,用镊子夹取砝码 |
| C、反应中没用完的药品,应立即放回原试剂瓶中,以免浪费 |
| D、给试管中液体加热时,试管口对着有人的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | N2(g)/mol | H2(g)/mol | NH3(g)/mol |
| ① | 0.5 | 1.5 | 0 |
| ② | 0.4 | 1.2 | 0.2 |
| ③ | 0.4 | 1.1 | 0.3 |
| A、实验①反应放出热量值Q1═0.1Q |
| B、实验①的H2平衡转化率为20% |
| C、实验③反应吸收热量 |
| D、该条件下氮氢合成氨的平衡常数约为0.058 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2O2中所含阴离子的数目是0.2×6.02×1023 |
| B、标准状况下,2.24 L 18O2中所含中子的数目是6.02×1023 |
| C、1 mol乙酸和甲酸甲酯的混合物中含共用电子对的数目是8×6.02×1023 |
| D、用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、探究二氧化硫和水反应可能有硫酸生成 |
| B、探究钠与水的反应产生的气体可能是氧气 |
| C、探究镁条表面灰黑色的物质可能只是氧化镁 |
| D、探究铜在灼烧时出现的黑色物质可能是炭黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶度积:Ag2CrO4大于AgCl |
| B、通过沉淀反应可使Ag+完全沉淀 |
| C、在0.010mol?L-1 AgNO3溶液中,AgCl的最大浓度为:1.7×10-8mol/L |
| D、分别用等体积蒸馏水和0.01mol/L HCl洗涤AgCl沉淀,用水洗涤造成AgCl损失量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol羟基中含有的电子数为5 NA |
| B、具有6.02×1023个中子的D2O的质量为4.0 g |
| C、C3H7O2N分子中含有氨基,0.1 mol该有机物含有共用电子对的数目为1.3 NA |
| D、0.1 mol?L-1的醋酸钠溶液中含有CH3COOH、CH3COO-粒子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
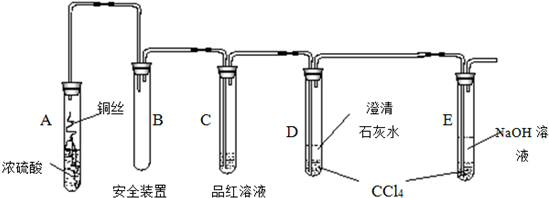
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com