
(1)在其他条件不变的情况下,研究改变起始氢气物质的量[用n(H2)表示]
对N2(g)+3H2(g) 2NH3(g)反应的影响且△H<0,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响且△H<0,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量): 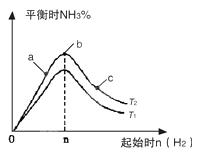
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,NH3体积分数为_________,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):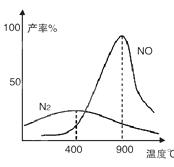
4NH3+5O2 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 2N2+6H2O温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是
2N2+6H2O温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是
(1)①c ②1; 42.9% K=25/12或2.08, 减小 ③低于
(2)N2, 氨气氧化生成NO的反应是放热反应,升高温度转化率下降
解析试题分析:(1)①起始时氢气的物质的量越多,则越有利于提高氮气的转化率,这说明反应物N2的转化率最高的应该是c点。
②H2的转化率均为60%,则消耗氢气是1.8mol,所以根据方程式可知,消耗氮气是0.6mol。又因为氮气的转化率也是60%,所以在起始时体系中加入N2的物质的量为1mol。生成氨气是1.2mol,则NH3体积分数为 ,该反应的平衡常数是
,该反应的平衡常数是 。正反应是放热反应,则升高温度,平衡向逆反应方向移动,所以当温度升高时该平衡常数将减小。
。正反应是放热反应,则升高温度,平衡向逆反应方向移动,所以当温度升高时该平衡常数将减小。
③正反应是放热反应,则升高温度,平衡向逆反应方向移动,所以当温度升高时氨气的含量降低,所以图像中T2和T1的关系是T2低于T1的。
(2)根据图像可知,当温度较低时以氮气为主。由于氨气氧化生成NO的反应是放热反应,升高温度转化率下降,所以NO产率下降。
考点:考查平衡常数和转化率的有关计算以及外界条件对平衡状态的影响
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题综合性强,侧重对学生基础知识的巩固和训练,同时注重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础性知识解决实际问题的能力,也有助于提升学生的学科素养。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 M(OH)2
M(OH)2  2H++MO22-
2H++MO22-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.1∶3∶1∶2 B.3∶1∶2∶2
C.3∶1∶2∶1 D.1∶3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,在密闭容器中进行的反应aX(g)+bY(g)![]() cZ(g)+dW(g),5 min后达到平衡,X减少n mol?L-1,Y减少
cZ(g)+dW(g),5 min后达到平衡,X减少n mol?L-1,Y减少![]() mol?L-1,Z增加
mol?L-1,Z增加![]() mol?L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为( )
mol?L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为( )
A.1∶3∶1∶2 B.3∶1∶2∶2
C.3∶1∶2∶1 D.1∶3∶2∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com