
 欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液480mL.试回答下列问题:
欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液480mL.试回答下列问题:| 1000ρω |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
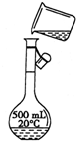 欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液500mL.试回答下列问题:
欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液500mL.试回答下列问题:查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省本溪一中高一第一次月考化学试卷(带解析) 题型:实验题
(10分)欲用质量分数为98%的浓硫酸(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
简要回答下列问题:
(1)量取所需浓硫酸的体积为_____________mL。
(2)如果实验室有15 mL、 20mL、 50mL的量筒,应选用_________mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取,使结果浓度_______(填“偏高”“偏低”“无影响”)
(3)下面是某学生的操作过程:
a.检查容量瓶是否漏水;
b.用(2)中选择的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500 mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1 cm~2 cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用。
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加)。
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________;
⑤_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一第一次月考化学试卷(解析版) 题型:实验题
(10分)欲用质量分数为98%的浓硫酸(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
简要回答下列问题:
(1)量取所需浓硫酸的体积为_____________mL。
(2)如果实验室有15 mL、 20mL、 50mL的量筒,应选用_________mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取,使结果浓度_______(填“偏高”“偏低”“无影响”)
(3)下面是某学生的操作过程:
a.检查容量瓶是否漏水;
b.用(2)中选择的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500 mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1 cm~2 cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用。
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加)。
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________;
⑤_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com