
| A. | NH3被氧化,表现氧化性 | |
| B. | 此条件下氧化性强弱为:Cl2>N2 | |
| C. | 若有8mol NH3 被氧化,生成的N2体积(标准状况)为22.4L | |
| D. | 若有3 mol e-转移,被还原的Cl2的物质的量为3mol |
分析 反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3与HCl反应生成氯化铵,有白烟生成,以此解答.
解答 解:A.N元素化合价升高,被氧化,表现还原性,故A错误;
B.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,则氧化性强弱为:Cl2>N2,故B正确;
C.若有8mol NH3 被氧化,由原子守恒可知生成4molN2,体积(标准状况)为89.6L,故C错误;
D.1mol氯气得到2mol电子,若有3 mol e-转移,被还原的Cl2的物质的量为1.5mol,故D错误.
故选B.
点评 本题考查氯气的性质、氧化还原反应,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 塑料降解技术与化学科学无关 | |
| B. | 新能源--可燃冰的利用与化学关系密切 | |
| C. | 在垃圾处理、污水治理等方面化学科学将大有作为 | |
| D. | 随着化学科学的发展,合成橡胶的品种将越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质中仅含C、H、O、N四种元素 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作
(1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、氨、四氯化碳均为电解质 | |
| D. | 胶体、食用盐、点豆腐的卤水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: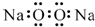 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: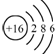 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com