
【题目】化学与生活密切相关,下列有关说法错误的是( )
A. 加热能杀死流感病毒是因为蛋白质受热变性
B. 氨基酸和蛋白质遇重金属离子均会变性
C. 用灼烧的方法可以区分蚕丝和人造纤维
D. 蛋白质水解的最终产物是氨基酸
科目:高中化学 来源: 题型:
【题目】在标准状况下,将某X气体V L溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是( )
A.134.4L B.67.2L C.44.8L D.537.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:A、B、C、D是初中化学中常见的不同类别的物质,已知A、B是空气中的两种气体,“![]() ”表示两种物质在一定条件下可相互转变。
”表示两种物质在一定条件下可相互转变。
![]()
依据给出的信息推断并回答下列问题:
(1)自然界B可通过_______________转化为A;
(2)B物质的一种用途是____________________;
(3)D物质所属的类别是____________________;
(4)C转化为B的微观实质是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:① KMnO4/H+ ② NaOH溶液 ③ 饱和Na2CO3溶液 ④ H2O
⑤ Na ⑥ Br2/H2O ⑦ Br2/CCl4
Ⅱ.装置:
选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是
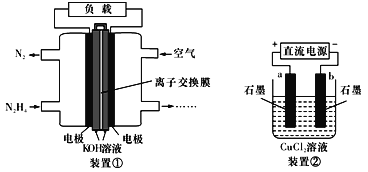
A. 该燃料电池负极发生的电极反应为:N2H4+4OH-4e-==N2↑+4H2O
B. 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4
C. 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧
D. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量SiO2)制备锑白的两种工艺如下:
I.火法制取锑白,是将辉锑矿装入氧化炉的坩埚中,高温使其熔化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式:________________________________________。
Ⅱ. 湿法制取锑白的工艺流程如图:

已知:
①Sb3+与Fe2+的氧化性强弱相当
②常温下:
化合物 | Fe(OH)2 | Fe(OH)3 | Sb(OH)3 |
Ksp近似值 | 8×10-16 | 4×10-26 | 4×10-42 |
③Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
④水解时保持溶液的c(H+)=0.1~0.3mol/L
(1)浸出是将辉锑矿溶于FeCl3溶液,请写出其中发生的氧化还原反应离子方程式_____________________________________________。滤渣的成分为______________________。
(2)采用铁粉作为还原剂进行还原,其目的是除去溶液中的离子___________(填离子符号),还原反应结束后,可用______________溶液来检验还原是否彻底。
(3)SbCl2是无色晶体,100升华,分子中所有原子都达到8e-稳定结构,请写出SbCl2的电子式____________________。
水解是利用SbCl2的水解反应制取Sb2O3(SbCl2的水解分为多步),其反应可以简单表示为:
SbCl3+3H2O![]() Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
为了促进水解趋于完全,可采取的措施(填两点):_____________________
(4)简述检验沉淀是否洗净的实验方法:__________________________________________。
(5)若不加铁还原,则最终所得锑白的产率将_____________________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些物质的有关数据如下表,回答以下问题:

实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是________________________,解释该现象的化学反应方程式为_________________________________________;
(2)若要证明铜丝起催化作用,还需要进行的操作是________________________________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:![]() (α-羟基乙磺酸钠)
(α-羟基乙磺酸钠)
(3)操作A的名称是 _____________________;
(4)写出Na2CO3溶液参与反应的化学方程式:______________________________;
(5)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。

①冷凝管中的液体应从 ________口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_________。(填字母)
a. 烧杯中应装冰水
b. 冷凝管应通温水
c. 图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验 试管 | pH | ||
第1次 | 第2次 | 笫3次 | |
a | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(6)试管a中乙醛溶液的物质的量浓度为______________mol·L-1。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题8分)
(1)化合物A的结构简式为: ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:_________;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为________。
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:_________;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为________。
(2)篮烷分子的键线式如图所示,试回答:

①写出篮烷分子的化学式____________
②篮烷分子的一氯取代物是种数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com