
| A. | 用渗析的方法精制Fe(OH)3胶体 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
分析 A.胶体不能透过半透膜,而离子可以;
B.胶体、溶液均可透过滤纸;
C.BaSO4、BaCO3均不溶于水;
D.NaCl、CaCl2、MgCl2均为可溶性盐.
解答 解:A.胶体不能透过半透膜,而离子可以,则用渗析的方法可精制Fe(OH)3胶体,故A正确;
B.胶体、溶液均可透过滤纸,则过滤不能除杂,应选渗析法,故B错误;
C.BaSO4、BaCO3均不溶于水,不能溶解、过滤分离,应加足量硫酸、过滤除杂,故C错误;
D.NaCl、CaCl2、MgCl2均为可溶性盐,则蒸发不能除杂,应加试剂将钙、镁离子转化为沉淀后过滤除杂,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
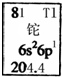
| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 仪器标号 | 1 | 2 | 3 | 4 | 5 |
| 试剂标号 | E | AFG | C | G | I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| PCl5 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 漂白粉-混合物 胆矾-纯净物 HD-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 盐酸-强电解质 硫酸钡-强电解质 醋酸-弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
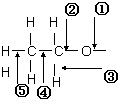 乙醇分子中各化学键如图所示:
乙醇分子中各化学键如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化三碳的电子式为:O::C::C::C::O: | |
| B. | C3O2、CO、CO2都是碳的氧化物 | |
| C. | C3O2和CO一样可以燃烧生成CO2 | |
| D. | C3O2不是碳酸的酸酐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com