
下列除杂方法正确的是( )
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
A.①②③ B.②④⑤ C.③④⑤ D.②③④
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。

(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________________。
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的__________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验:
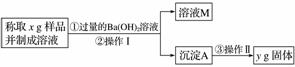
①操作Ⅰ涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得的样品中Na2CO3质量分数的计算式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH溶液、浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
| D | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下除杂方法(括号内为少量杂质)中,错误的是( )
A.NaCl(Na2CO3):溶解,滴入足量盐酸,蒸发结晶
B.Na2SO4(NH4Cl):加热、升华
C.CO2(CO):通过灼热CuO粉末
D.H2(NH3):通过盛浓H2SO4的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO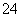 。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
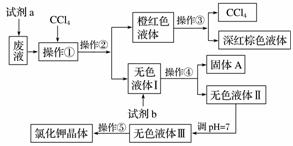
可供试剂a、试剂b(试剂b代表一组试剂)选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用____________。
(2)操作①②③④⑤的名称是__________(填字母)。
A.萃取、过滤、分液、过滤、蒸发结晶
B.萃取、分液、蒸馏、过滤、蒸发结晶
C.分液、萃取、过滤、过滤、蒸发结晶
D.萃取、分液、分液、过滤、蒸发结晶
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO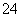 ,选出试剂b所代表的试剂,按滴加顺序依次是________________________(填化学式)。
,选出试剂b所代表的试剂,按滴加顺序依次是________________________(填化学式)。
(4)调节pH的作用是__________________,操作方法是________。
(5)操作⑤中用到的瓷质仪器名称是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是________和________;________和
________________________。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO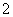 互为等电子体的分子有________、________。
互为等电子体的分子有________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断含氧酸酸性强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
| 次氯酸 | 磷酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |
|
|
| 非羟基氧原子数 | 0 | 1 | 3 |
| 酸性 | 弱酸 | 中强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为①________________,②________________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况:________________________________________________________________________,
写出化学方程式:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是 ( )。
A.电池总反应为Mg+H2O2===Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e-===2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com