
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 压缩容器体积平衡向正反应方向移动,达到新的平衡后c(A2)变小 | |
| C. | 平衡后加入A2,达到新的平衡A2 和B2的转化率均增大 | |
| D. | 达到平衡后,降低温度或增大压强都有利于该反应平衡正向移动 |
分析 对于反应A2(g)+2B2(g)?2AB2(g)△H<0,正反应为放热反应,升高温度,平衡逆向移动,反应物气体的计量数之和大于生成物,则增大压强,平衡正向移动,以此解答该题.
解答 解:A.升高温度,正逆反应速率都增大,故A错误;
B.压缩容器体积平衡向正反应方向移动,但因体积减小,则达到新的平衡后c(A2)增大,故B错误;
C.平衡后加入A2,达到新的平衡A2 的转化率减小,B2的转化率增大,故C错误;
D.正反应为放热反应,降低温度,平衡正向移动,反应物气体的计量数之和大于生成物,则增大压强,平衡正向移动,故D正确.
故选D.
点评 本题考查化学平衡的影响因素,为高频考点,侧重考查学生的分析能力,把握温度、压强、催化剂对反应速率及平衡的影响即可解答,注意催化剂不能改变△H为解答的易错点,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 达到平衡后,加入催化剂则c%增大 | |
| B. | 该反应的△H<0 | |
| C. | 化学方程式中n>p+q | |
| D. | 达到平衡后,增加A的量有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Fe是负极,NiO2是正极 | |
| B. | 蓄电池的电极可以浸入某中酸性电解质溶液中 | |
| C. | 充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- | |
| D. | 放电时,电解质溶液中的阴离子向负极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-丙基辛烷 的名称为2,4-二乙基-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立体结构)有15种 | |
| D. | 某有机物的结构简式是  ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
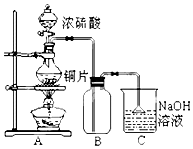 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C3H6 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com