
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | 氢化物的稳定性为H2E<H2D | |
| C. | B与E形成的化合物既能溶于盐酸又可溶于氢氧化钠溶液 | |
| D. | 最高价氧化物对应水化物碱性:B比A的强 |
分析 在短周期主族元素中,元素的最高正化合价与其族序数相等,非金属元素负化合价数值=族序数-8,原子的电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小;
A、C属于第IIA族元素,A原子半径大于C,则A是Mg元素、C是Be元素;
B属于第IIIA族元素,A原子半径大于B,则B是Al元素;
D、E最低负价是-2价,则二者属于第VIA族元素,D有正化合价,则D为S元素、E为O元素,再结合题目分析解答.
解答 解:在短周期主族元素中,元素的最高正化合价与其族序数相等,非金属元素负化合价数值=族序数-8,原子的电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小;
A、C属于第IIA族元素,A原子半径大于C,则A是Mg元素、C是Be元素;
B属于第IIIA族元素,A原子半径大于B,则B是Al元素;
D、E最低负价是-2价,则二者属于第VIA族元素,D有正化合价,则D为S元素、E为O元素;
A.A是Mg元素、D是S元素,Mg2+核外电子数是10、S2-的核外电子数是18,所以二者核外电子数不等,故A错误;
B.元素的非金属性越强,其氢化物越稳定,非金属性O>S,即E>D,所以氢化物的稳定性为H2E>H2D,故B错误;
C.B是Al元素、E是O元素,形成的化合物是Al2O3,氧化铝属于两性氧化物,既能与强酸反应又能与强碱反应,故C正确;
D.A是Mg元素、B是Al元素,元素的金属性越强,最高价氧化物对应水化物碱性越强,金属性Mg>Al,最高价氧化物对应水化物碱性:A比B的强,故D错误;
故选C.
点评 本题考查了原子结构和元素性质,明确元素化合价、原子半径与原子结构的关系是解本题关键,再结合元素周期律分析解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
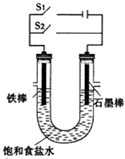 依据电化学反应原理,设计如图所示实验装置.请根据要求回答下列问题.
依据电化学反应原理,设计如图所示实验装置.请根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 木炭燃烧 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的酸性逐渐增强 | B. | 铜片逐渐溶解 | ||
| C. | 溶液中H+向锌片作定向移动 | D. | 锌片是负极并被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B的质子数是10 | B. | 10B20是一种新合成的化合物 | ||
| C. | 10B的中子数与核外电子数相同 | D. | B元素位于元素周期表中的第三列 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be(OH)2是两性氢氧化物 | |||||
| B. | 硫粉不溶于水,易溶于CS2中 | |||||
| C. | O3与SO2的结构不相似 | |||||
| D. | 由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com