
| A、增大FeO(s)表面积 |
| B、增大体系压强 |
| C、升高体系温度 |
| D、使用适合的催化剂 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
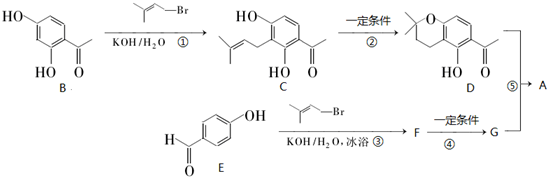
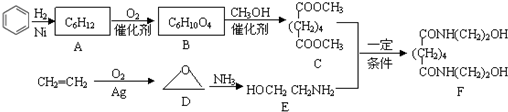
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B、能使酚酞变红色的溶液中:Na+、K+、S2-、SO32- |
| C、室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、F- |
| D、含大量Fe3+的溶液中:NH4+、Na+、C1-、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:
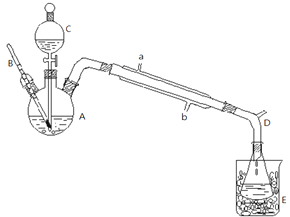
| 140℃ |
| 名称 | 相分子质量 | 密度 g/mL | 熔点 ℃ | 沸点 ℃ | 溶解度:g/100mL溶剂 | ||
| 水 | 醇 | 醚 | |||||
| 浓H2SO4 | 98.00 | 1.84 | 10.35 | 340 | |||
| 乙醚 | 74.00 | 0.71 | -89.12 | 34.5 | 能溶 | 混溶 | 混溶 |
| 乙醇 | 46.00 | 0.780 | -114.5 | 78.4 | ∞ | ∞ | ∞ |
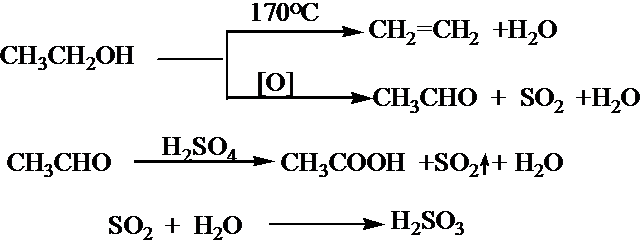
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com