
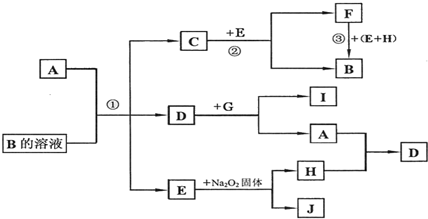
分析 单质A与B的溶液反应得到气体C、D,应是碳与浓硫酸或浓硝酸反应,故A为碳,E为H2O,则单质H为O2,J为NaOH.而C与E(水)反应得到气体F与B,且F与水、氧气反应也得到B,可推知C为NO2,D为CO2,则F为NO,B为HNO3,二氧化碳与G反应得到碳与I,则G为Mg,I为CO.
解答 解:单质A与B的溶液反应得到气体C、D,应是碳与浓硫酸或浓硝酸反应,故A为碳,E为H2O,则单质H为O2,J为NaOH.而C与E(水)反应得到气体F与B,且F与水、氧气反应也得到B,可推知C为NO2,D为CO2,则F为NO,B为HNO3,二氧化碳与G反应得到碳与I,则G为Mg,I为CO.
(1)物质C、E的化学式分别为NO2、H2O,
故答案为:NO2;H2O;
(2)物质D为CO2,结构式为O=C=O,G可能的化学式为Mg,
故答案为:O=C=O;Mg;
(3)反应①的化学方程式为:4HNO3(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
反应②的化学方程式为:3NO2+H2O═2HNO3+NO,
反应③的化学方程式为:4NO+3O2+2H2O═4HNO3 ,
故答案为:4HNO3(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;3NO2+H2O═2HNO3+NO;4NO+3O2+2H2O═4HNO3 ;
(4)将金属铝片和碳的某种同素异形体作电极,一定浓度的NaOH的水溶液作电解质溶液构成原电池,Al为负极,负极的电极反应为:Al+4OH--3e-═AlO2-+2H2O,原电池总反应的离子方程式为:2Al+2OH-+2H2O═AlO2-+3H2↑,
故答案为:Al+4OH--3e-═AlO2-+2H2O;2Al+2OH-+2H2O═AlO2-+3H2↑.
点评 本题考查无机物的推断,转化中特殊反应是推断突破口,需要学生熟练掌握元素化合物的性质,难度之大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
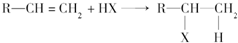
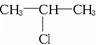 ,C:CH3CH2CH2OH,D:
,C:CH3CH2CH2OH,D: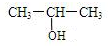 ,E:CH3CH=CH2.
,E:CH3CH=CH2. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$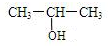 +NaCl;
+NaCl;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
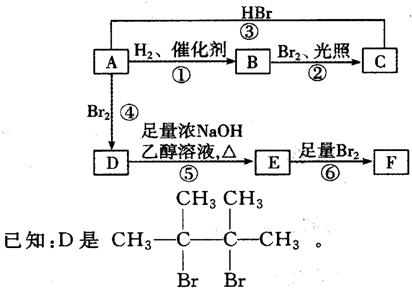
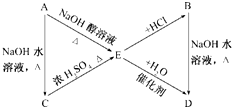
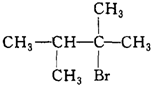 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式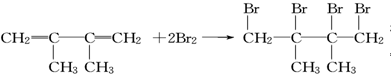 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.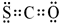 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
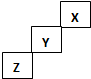
| A. | Z一定是活泼的金属元素 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | Y的气态氢化物最稳定 | |
| D. | Z单质可与盐酸反应置换出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
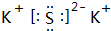 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com