
分析 (1)根据高锰酸钾在不同的条件下发生的反应的现象分析,不同环境中反应后的离子颜色不同,结合溶液酸碱性判断;
(2)得电子化合价降低的微粒发生还原反应,标注元素化合价的升高降低来判断;
(3)同一氧化还原反应中氧化剂的氧化性大于还原产物的氧化性;
(4)根据氧化还原反应中得失电子数相等配平方程式,并注意也要遵循原子守恒,该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是25,硫化钾的计量数是5;根据硫单质和转移电子之间的关系式计算转移电子数.
解答 解:(1)根据反应式知,不同环境中反应后的离子颜色不同,溶液的酸碱性不同溶液的颜色不同,所以溶液的颜色受溶液酸碱性的影响,故答案为:酸碱性;
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-→Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选A;
(4)①该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是28,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O,
故答案为:28;5;24KOH;28;3;2;12H2O;
②根据①的分析,反应28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O过程中电子转移总数为28e-,
若生成6.4 g单质硫,设转移电子数是x,
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28mol
$\frac{6.4g}{32g/mol}$=0.2mol x=2.8mol
故答案为:2.8mol.
点评 本题考查了有关物质的量的计算、氧化性和还原性的判断等知识点,难度中等,明确氧化性和还原性强弱的判断方法.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:推断题
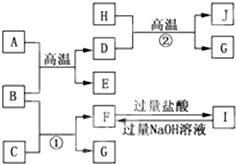 如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.
如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知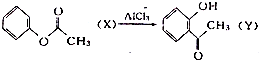 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 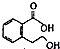 能发生的反应类型:加成反应、取代反应、消去反应、水解反应 能发生的反应类型:加成反应、取代反应、消去反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯代物有3种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比其在乙醇中的溶解度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个CO2分子占有的体积一定为22.4L | |
| B. | 标准状况下,22.4L四氯化碳含有的分子数为NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示): ,基态R原子的价电子排布式为2s22p4.
,基态R原子的价电子排布式为2s22p4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
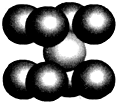 已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com