
【题目】在盛有饱和硫酸钠溶液的烧杯中,保持温度不变,用惰性电极电解一定时间后( )
A. 溶液的pH值将增大B. 钠离子数和硫酸根离子数的比值将变小
C. 溶液的浓度逐渐增大,有一定量晶体析出D. 溶液的浓度不变,有晶体析出
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 物质 | 选用的试剂 | 操作方法 |
A | NaCl(泥沙) | 水 | 过滤 |
B | CO2(CO) | O2 | 点燃 |
C | Fe(Zn) | 稀硫酸 | 结晶 |
D | CO2(HCl) | NaOH溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
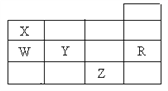
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,Q的核电荷数是X与Z的核电荷数之和, E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___________、____________;
(2)XZ2与YZ2分子的立体结构分别是___________和___________,在水中溶解度较大的是________(填化学式);
(3)Q元素的价电子排布图为___________,在形成化合物时它的最高化合价为_____;
(4)Z与E形成的化合物中,各原子最外层都达到8电子结构,该化合物中心原子采用的轨道杂化方式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )

A. 4︰1B. 3︰1C. 2︰1D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。下列说法错误的是( )

A.放电过程中右槽溶液颜色逐渐由绿色变为紫色
B.放电过程中氢离子的作用之一是参与正极反应
C.充电过程中左槽溶液逐渐由蓝变黄
D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属有M沉淀出来,

请回答下列问题:
(1)其中P是______极,B是______极。
(2)写出A极、B极、C极、D极上的电极反应式。
A极上电极反应式为____________________________________________________。
B极上电极反应式为____________________________________________________。
C极上电极反应式为____________________________________________________。
D极上电极反应式为____________________________________________________。
(3)当电路中通过2.4081022个电子时,B极上沉淀出1.28gM,则M的相对原子质量为__________。
(4)如果将电池的正负极交换,接入原电路通过1.2041022个电子时,则 B极上的电极反应式为____________________________________________,A极上析出______ g ______(填物质名称),甲池的总反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,不正确的是( )
 (甲)
(甲)  (乙)
(乙)  (丙)
(丙)  (丁)
(丁)
A. 甲是过量的两份锌粉a、b分别加到100mL等浓度的稀硫酸中,同时向a中加入少量CuSO4溶液,产生H2的体积V(L)与时间(min)的关系图
B. 由乙可知,通电A极上有红色固体析出,说明锌的金属性比铜强
C. 由丙可知,装置工作一段时间后,a极附近溶液的pH増大
D. 由丁可形成铜锌原电池,且电路中每转移2mol电子,在正极会析出64g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________,样品中S2-的含量为____________(写出表达式与计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com